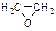1 3―丙二醇是重要的化工原料 用乙烯合成1 3―丙二醇的路线如下:CH2=CH2 HOCH2CH2
| 1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下: CH2=CH2 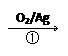 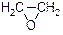 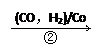 HOCH2CH2CHO HOCH2CH2CHO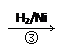 HOCH2CH2CH2OH HOCH2CH2CH2OH⑴通过反应①用乙烯和空气混合气体制备  ,测得反应前和某一时刻气体的体积分数如下表。 ,测得反应前和某一时刻气体的体积分数如下表。
⑵某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得: C+H2O  CO+H2 CH4+H2O CO+H2 CH4+H2O CO+3H2 CO+3H2假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%。 计算至少需要焦炭、甲烷各多少吨,才能满足生产需要? |
参考解答
| (1)80%(2)焦炭3.6t,甲烷4.8t。 |
| ⑴设反应前气体共有100L 则反应前V(C2H4)=100L×25.0%=25L,V(N2)=100L×60.0%=60L 因为N2的体积不发生变化,则此时气体的体积为60L÷66.7%=90L V(C2H4)=90L×5.56%=5.00L 则此时乙烯的转化率= 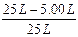 ×100%='80.0% ' ×100%='80.0% ' 也可以这样求乙烯转化率: 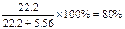 ⑵反应②中 C2H4 ~ CO ~ H2 ~ HOCH2CH2CHO 28 28 2 74 14t m(CO)× 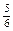 m(H2)× m(H2)×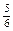 m(HOCH2CH2CHO) m(HOCH2CH2CHO)则m(CO)=16.8 t m(H2)='1.2t ' m(HOCH2CH2CHO) ='37' t 反应③中 HOCH2CH2CHO ~ H2 74 2 37t m(H2)× 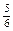 则m(H2)='1.2t ' 反应②、③中共需CO16.8 t、H22.4t。 C + H2O 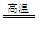 CO + H2 CH4 + H2O CO + H2 CH4 + H2O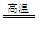 CO + 3H2 CO + 3H212 28 2 16 28 6 m(C) m(CH4) 得方程组 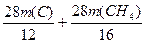 =16.8 t 和 =16.8 t 和 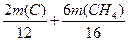 =2.4t =2.4t解得m(C)='3.6t ' m(CH4)='4.8t' |
相似问题
下列实验能成功的是( ) A.将铁屑 溴水 苯混合制溴苯 B.苯和硝基苯采用分液的方法
下列实验能成功的是() A.将铁屑、溴水、苯混合制溴苯 B.苯和硝基苯采用分液的方法分离 C.聚乙烯使酸性KMnO4溶液退色 D.用水鉴别:苯、乙醇、四氯化碳
下列四种醇既可发生消去反应 又可被催化氧化的是
下列四种醇既可发生消去反应,又可被催化氧化的是
乙醇作为燃料的优点是:①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境③乙醇是一种可再生能
乙醇作为燃料的优点是:①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境③乙醇是一种可再生能源 ④燃烧时放出大量热量A.①②③ B.
把一端弯成螺旋状的铜丝放在酒精灯外焰上加热 趁热迅速把它插入盛有乙醇的试管中。观察铜丝上的实验现象:
把一端弯成螺旋状的铜丝放在酒精灯外焰上加热,趁热迅速把它插入盛有乙醇的试管中。观察铜丝上的实验现象:。写出乙醇与O2催化氧化成乙醛的化学方程式。。
从多年生草木植物胡黄连中提取的胡黄连苷III的结构式如下图所示 可用于清热类药物。下列叙述中不正确的
从多年生草木植物胡黄连中提取的胡黄连苷III的结构式如下图所示,可用于清热类药物。下列叙述中不正确的是()A.分子式为C17H20O9B.属于芳香族化合物C