(12分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl
| (12分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题: (1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是 。 (2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料: Ⅰ.铁有一种化合物称为铁酸盐(含有FeO42-)。 Ⅱ.SCN-的电子式为 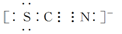 III.氯水具有很强的氧化性。 于是同学们提出两种假设: ①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式__________。 ②第二种假设是:____________,提出该假设的理论依据是___________________ |
参考解答
| (1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色 ②FeCl2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)①2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+ ②SCN-被Cl2氧化 从电子式分析,SCN-中S为负二价,N为负三价,均为最低价有被氧化的可能 |
本题以铁元素及其化合物的知识点为基础,考查方程式书写基本功,以及提出问题,分析问题,解决问题的能力。 ⑴Fe2++2OH―=Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3 ①产生白色沉淀,迅速变为灰绿色,最终变成红褐色,②方程式这FeCl2+2NaOH===Fe(OH)2↓+2NaCl、 4Fe(OH)2+O2+2H2O===4Fe(OH)3;Cl2可将Fe3+氧化(2)①2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+ ②SCN-被Cl2氧化 从电子式分析,SCN-中S为负二价,N为负三价,均为最低价有被氧化的可能。 |
相似问题
易拉罐主要为铝合金 其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验 其中实验方案
易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是序号实验方案现象、结论A
孔雀石主要含Cu2(OH)2CO3 还含少量杂质FeO Fe2O3 SiO2。实验室以孔雀石为原料制
孔雀石主要含Cu2(OH)2CO3,还含少量杂质FeO、Fe2O3、SiO2。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:请回答下列问题:(1)溶液A的金属离
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应 并探讨反应所产生气体的性质。请回答下列问
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:①通过试管乙中发生的 现象说明
(10分)为了测定乙醇的分子结构 有人设计了图甲所示的用无水乙醇与钠反应并测定H2的体积的实验装置。
(10分)为了测定乙醇的分子结构,有人设计了图甲所示的用无水乙醇与钠反应并测定H2的体积的实验装置。回答下列有关问题:(1)乙醇与钠反应方程式为:__
配制一定溶质物质的量浓度的KOH溶液时 造成实验结果偏低的原因可能是( )A.容量瓶中有少量水B.
配制一定溶质物质的量浓度的KOH溶液时,造成实验结果偏低的原因可能是( )A.容量瓶中有少量水B.有少量KOH残留在烧杯中C.定容时俯视D.定容时仰视












