某同学为了探究碳酸的酸性强弱 设计了如图所示的装置。 (1)A为碳酸钙 B为浓醋酸 C为硅酸钠溶液
| 某同学为了探究碳酸的酸性强弱,设计了如图所示的装置。 |
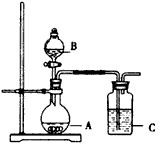 |
| (1)A为碳酸钙,B为浓醋酸,C为硅酸钠溶液,实验现象:C中产生白色胶状沉淀。由此可得出结论:醋酸的酸性比碳酸的酸性强。你认为这个结论合理吗?_____,原因是______________________,改进的方法是__________________。 (2)少量CO2与硅酸钠溶液反应。对其除硅酸沉淀外的反应产物,不同的同学持有不同的观点:甲同学认为是碳酸钠、乙同学认为是碳酸氢钠。请设计一个简单的实验验证:__________。 (3)若A为NaHCO3,B为稀硫酸,C为漂白粉溶液,实验现象为:C中产生白色沉淀。文献资料的观点是,该实验能证明碳酸比次氯酸的酸性强。小明则认为该实验不能证明碳酸一定比次氯酸的酸性强。他的理由是_______________。本实验告诉我们:在保存漂白粉时要注意的事项是________________。 (4)在常温下高锰酸钾能将浓盐酸氧化成Cl2。若将A 改为KMnO4,B为浓盐酸,C为淀粉KI溶液,______ (填“能”或“不能”)用此装置来验证氯、碘的非金属性强弱,若不能,需如何改进____________,若能,此问不用回答。 |
参考解答
| (1)不合理;醋酸具有挥发性,C中生成的白色胶状沉淀可能是Na2SiO3与醋酸反应所得在;A与C之间增加盛有饱和NaHCO3溶液的洗气瓶(其他合理答案也可) (2)取C中反应后的上层溶液少许于试管中,加入氯化钙溶液,若有白色沉淀生成,则甲同学观点正确;若无明显现象,则乙同学观点正确 (3)CO2溶于水,与Ca(ClO)2反应生成难溶于水的CaCO3,减小了溶液中的离子浓度,使反应能够发生; 密封、干燥 (4)不能;增加尾气的处理装置,因为Cl2扩散到空气中会导致大气污染 |
相似问题
某研究小组用MnO2和浓盐酸制备Cl2时 利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
某研究小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=_
下图是用来进行乙醇的氧化和氧化产物的检验的实验装置。可供选择的试剂有:氧化铜粉末 乙醇 新制氢氧化钙
下图是用来进行乙醇的氧化和氧化产物的检验的实验装置。可供选择的试剂有:氧化铜粉末、乙醇、新制氢氧化钙悬浊液、银氨溶液,溴水、高锰酸钾溶液所需其
有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积 具体步骤为:准确称出m g NaCl 晶体粉
有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出m g NaCl 晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a
类比是化学学习中常用的方法之一 已知硝酸能把铁氧化成Fe(NO3)3 但当铁过量时 产物是Fe(NO
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应
已知氨可以与灼热的氧化铜反应得到氮气和金属铜 用示意图中的装置可以实现该反应。回答下列问题:(1)A
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。回答下列问题:(1)A中加入的物质是_________,发生反应的化学方程式












