探究性问题在理论指导元素化合物实验具有重要意义。[问题] 对于已达平衡的可逆反应 当其它条件不变时
| 探究性问题在理论指导元素化合物实验具有重要意义。 [问题] 对于已达平衡的可逆反应,当其它条件不变时,改变反应物或生成物的浓度会对化学平衡有何影响? [猜想与假设] 假设1:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向正反应方向移动。 假设2:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向逆反应方向移动。 假设3:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向逆反应方向移动。 假设4:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向正反应方向移动。 [设计和实施方案] 在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液 ②KSCN溶液 ③KCl固体 ④NaF溶液实验用品:仪器:烧杯、玻璃棒、胶头滴管试剂:FeCl3(aq)(0.01 mol/L,1.0 mol/L),KSCN(aq)(0.01 mol/L,1.0 mol/L),KCl(s), NaF(aq)(1.0 mol/L)。 实验步骤: 1.往250 mL烧杯中加入100 mL蒸馏水,然后加入10 mL 0.01 mol/L FeCl3溶液,再加入10 mL 0.01 mol/L KSCN溶液,溶液由黄色变成橙红色。 2.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 Ml加到5支试管中。往1号试管滴加2~3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0 mol/L NaF溶液,振荡,观察现象。 (1)根据你所学的内容完成下列表格,并回答有关问题。FeCl3与KSCN溶液反应 |
 |
| (2)由①②现象说明假设______成立,假设______不成立。 (3)根据Fe3++3SCN- 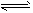 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是_____________________。 (4)根据“4”号试管中的现象,分析在4号试管中发生的变化是____________,说明了 __________(从改变浓度影响平衡移动角度回答) |
参考解答
| (1)①加深;血红;②加深;血红;③右;④右;⑤左;⑥左 (2)1;2 (3)Fe3+与Cl-形成络离子,使Fe3+浓度减小,平衡向左移动 (4)F-与Fe3+形成了无色的且比Fe(SCN)3稳定的化合物(络合物);减小反应物的浓度会使平衡向逆反应方向移动 |
相似问题
Fenton法常用于处理含难降解有机物的工业废水 通常是在调节好PH和浓度的废水中加入H2O2 所产
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污
钠在空气中燃烧(如图中甲)生成产物的固体物质中除有黄色粉末外 还有黑色固体物质--炭。(1)请假设黑
钠在空气中燃烧(如图中甲)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质--炭。(1)请假设黑色固体物质产生的原因可能是:假设①______________
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白: (1)实验化学反应原理:_
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白: (1)实验化学反应原理:______________________ 。 (2)实验用品:试
为证明有关物质的性质 某学生设计了如图装置 当打开活塞C 使液体A与隔板H上的固体B相遇时 即有气体
为证明有关物质的性质,某学生设计了如图装置,当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭,关闭C打开E时,则看
(1)用简单的实验证明在氨水中存在NH3·H2ONH4++OH-的电离平衡(要求写出简单操作 现象及
(1)用简单的实验证明在氨水中存在NH3·H2ONH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。(2)












