某同学想通过下图装置(夹持装置已略去)实验 探究SO2与Na2O2反应的产物.Ⅰ.装置D的作用___
某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.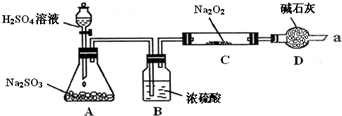 Ⅰ.装置D的作用______. Ⅱ.如何检验反应中是否有O2生成______. Ⅲ.对C中固体产物提出如下假设: 假设1:只有Na2SO3 假设2:只有Na2SO4 (1)装置C中,假设2的反应方程式为______. (2)乙同针对以上两个假设,提出了两个实验方案方案 ①在Na2O2反应完全后,为进行如上图实验: C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3得出结论:产物是Na2SO4.该方案是否合理______ (填“是”或“否”),理由是______. 方案②在反应进行一段时间后,取少量C中固体放入BaCl2溶液中,充分反应后再加入足量稀盐酸,如果溶液中出现白色沉淀,可得出结论,产物是Na2SO4,假设2成立,此方案是否合理______(填”是”或”否”)理由是______. |
参考解答
| I.二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气. 故答案为:吸收二氧化硫尾气,防止污染; II.氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有. 故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成. III.(1)过氧化钠有强氧化性,二氧化硫有还原性,所以过氧化钠和二氧化硫能发生氧化还原反应生成硫酸钠. 故答案为:Na2O2+SO2=Na2SO4. (2)①亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理. 故答案为:否,稀硝酸能将生成的BaSO3 氧化为BaSO4而使沉淀不溶于稀硝酸. ②若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀,干扰亚硫酸钠的检验,所以该方案不合理. 故答案为:否,若固体C中剩余Na2O2,产物为Na2SO3时,将固体C溶于BaCl2溶液时,Na2O2与水反应产生的氧气能将Na2SO3氧化为Na2SO4,而产生不溶于盐酸的BaSO4白色沉淀. |
相似问题
下列各组物质的水溶液不用其它试剂无法鉴别的是( )A.NaOH AlCl3B.CuSO4BaCl2
下列各组物质的水溶液不用其它试剂无法鉴别的是( )A.NaOHAlCl3B.CuSO4BaCl2C.NaAlO2HClD.MgCl2NaCl
金属钠与水的反应是中学化学中的一个重要反应.在高中化学教材的几次改版中该实验曾出现过几种不同的演示方
金属钠与水的反应是中学化学中的一个重要反应.在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如图中甲、乙、丙所示:(1)现按图甲
Cu+在酸性溶液中不稳定 可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸 浓硝酸 稀硫酸 稀
Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用
能把K2SO4 Ba(NO3)2 Na2CO3三种无色溶液鉴别出来的一种试剂是( )A.KNO3溶
能把K2SO4、Ba(NO3)2、Na2CO3三种无色溶液鉴别出来的一种试剂是( )A.KNO3溶液B.稀硫酸C.NaOH溶液D.Na2SO4溶液
为了达到下表中的实验要求 请选择合适的化学试剂及实验方法 将其标号填入对应的空格中.实验目的试剂及方
为了达到下表中的实验要求,请选择合适的化学试剂及实验方法,将其标号填入对应的空格中.实验目的试剂及方法测定某废水的pH检验早晨的自来水是否含Cl2分












