某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中 出现了白色浑浊
| 某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中,出现了白色浑浊物。 ⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为: SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。 ⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下: |
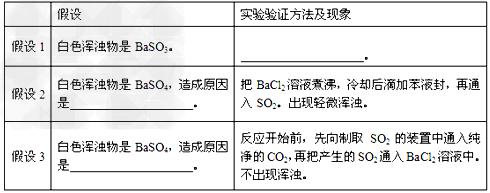 |
| 请把上表填充完全。 ⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、 _______________; ⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。 |
参考解答
| ⑴BaSO3的溶度积或BaSO3的溶解度 ⑵假设1:在白色浑浊物中加入过量盐酸,变澄清;假设2:BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸;假设3:SO2中混有空气,把亚硫酸氧化成硫酸 ⑶2SO2 +O2 +2H2O = 2H2SO4或SO2 +H2O =H2SO3、2H2SO3 + O2=2H2SO4;H2SO4 + BaCl2= BaSO4↓+2HCl ⑷BaCl2溶液中混有Ba(NO)3、HNO3、H2O2、Fe3+等均可 |
相似问题
某同学用同一种Mg Al合金进行甲 乙 丙三组实验 测得如下数据(盐酸的物质的量浓度相等) 下列分
某同学用同一种Mg、Al合金进行甲、乙、丙三组实验,测得如下数据(盐酸的物质的量浓度相等), 下列分析推理不正确的是[ ]A.甲组实验中盐酸过量 B.
已知单质硫是淡黄色固体粉末 难溶于水。实验室制氯气的反应原理为:MnO2+4HCl(浓)MnCl2+
已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某
某学生为验证苯酚 醋酸 碳酸的酸性强弱 经过慎重考虑 设计如下实验装置:请回答下列问题(1)各仪器中
某学生为验证苯酚、醋酸、碳酸的酸性强弱,经过慎重考虑,设计如下实验装置:请回答下列问题(1)各仪器中所盛放的药品是A______C______D______,(将序号
2008年5月12日我国四川汶川发生特大地震 为防止在大灾之后疫病流行 全国各地向灾区运送了大量的各
2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液。某学校探究性学习小组对消毒
“碘钟”实验中 3I-+ S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显
“碘钟”实验中,3I-+ S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行












