Ⅰ.从海水得到的粗食盐水中常含Ca2+ Mg2+ SO42- 需要分离提纯.现有含少量CaCl2 M
Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来除去食盐水中Ca2+、Mg2+、O42-.提纯的操作步骤和加入试剂的情况如图1:图中a、b、c、d分别表示上述4种试剂中的一种,试回答: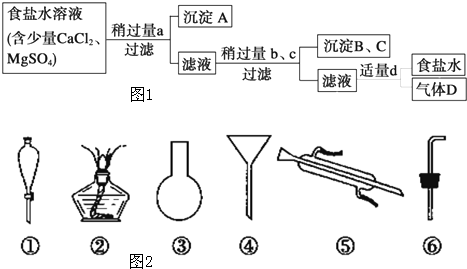 (1)沉淀A的名称是______; (2)试剂d是______;判断试剂d已经足量的方法是______; (3)现有图2仪器,过滤出沉淀A、B、C时必须用到______(填序号),仪器③的名称是______. Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是______(填序号). Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的______(填序号),该仪器名称为______,向该碘水中加入四氯化碳以提取碘单质的实验操作为______. |
参考解答
| 根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠. Ⅰ、镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都行;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀;但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡.离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子, (1)4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来除去食盐水中Ca2+、Mg2+、SO42-,加入试剂的顺序是④③②①,氯化钡可以将硫酸根离子沉淀,所以沉淀A是硫酸钡,故答案为:硫酸钡; (2)试剂d是盐酸,盐酸可以和碳酸根离子之间反应生成水以及二氧化碳,当不再产生二氧化碳时,证明盐酸已经过量,故答案为:盐酸;溶液中不会再产生气体; (3)过滤实验用到的仪器:漏斗、玻璃棒、烧杯等,根据实验装置,过滤出沉淀A、B、C时必须用到漏斗,仪器③的名称是圆底烧瓶,故答案为:④;圆底烧瓶; Ⅱ、蒸馏装置需要的仪器有:蒸馏烧瓶、单孔塞、冷凝管、牛角管、锥形瓶,故答案为:②⑤⑥; Ⅲ、从碘水中提取碘,可以采取萃取分液操作,使用的萃取剂是四氯化碳,使用的仪器是分液漏斗,故答案为:①;分液漏斗;萃取. |
相似问题
某食盐溶液中含有Ca2+ Mg2+等杂质离子 现设计实验 采用常见的试剂 精制食盐溶液.回答下列问题
某食盐溶液中含有Ca2+、Mg2+等杂质离子,现设计实验,采用常见的试剂,精制食盐溶液.回答下列问题:(1)操作:依次向溶液中加入足量的______溶液和足量
海水中有非常丰富的化学资源 从海水中可提取多种化工原料.试回答下列问题:(1)粗盐中含有Ca2+ M
海水中有非常丰富的化学资源,从海水中可提取多种化工原料.试回答下列问题:(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时
为了除去粗盐中的Ca2+ Mg2+ SO42-及泥沙 可将粗盐溶于水 然后进行以下五项操作:①过
为了除去粗盐中的Ca2+ 、Mg2+ 、SO42-及泥沙,可将粗盐溶于水,然后进行以下五项操作:①过滤;②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶
从碘水中用萃取法提取碘时 不能使用的试剂是[ ]A.酒精 B.汽油 C.四氯化碳D.苯
从碘水中用萃取法提取碘时,不能使用的试剂是[ ]A.酒精 B.汽油 C.四氯化碳D.苯
配制一定物质的量浓度的某溶液 下列情况会使配制结果偏低的是( )A.未冷却即转移 定容B.未洗涤烧
配制一定物质的量浓度的某溶液,下列情况会使配制结果偏低的是( )A.未冷却即转移、定容B.未洗涤烧杯及玻璃棒C.定容时俯视刻度线D.容量瓶中原有












