利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解
利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。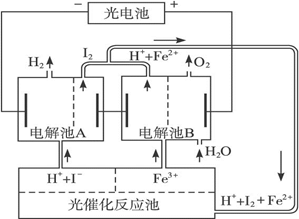 (1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。 (2)若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。 (3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。 |
参考解答
(1)A:2H++2I- H2↑+I2 ;B:4Fe3++2H2O H2↑+I2 ;B:4Fe3++2H2O  O2↑+4H++4Fe2+ O2↑+4H++4Fe2+光催化反应池:2Fe2++I2  2Fe3++2I- (2)0.300 mol (3) 2Fe3++2I- (2)0.300 mol (3) 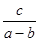 L·min-1 L·min-1 |
试题分析:(1)电解池A中,H+和I-反应生成H2和I2,则反应的离子方程式是2H++2I- 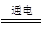 H2↑+I2。电解池B中,Fe3+和H2O反应生成O2、H+和Fe2+,则反应的离子方程式是4Fe3++2H2O H2↑+I2。电解池B中,Fe3+和H2O反应生成O2、H+和Fe2+,则反应的离子方程式是4Fe3++2H2O 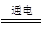 O2↑+4H++4Fe2+。光催化反应池中,H+、I2、Fe2+反应生成H+、I-和Fe3+,则光催化反应池中的离子方程式是2Fe2++I2 O2↑+4H++4Fe2+。光催化反应池中,H+、I2、Fe2+反应生成H+、I-和Fe3+,则光催化反应池中的离子方程式是2Fe2++I2 2Fe3++2I-。 2Fe3++2I-。(2)n(H2)= 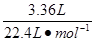 =0.150 mol =0.150 mol转移电子的物质的量为n(e-)=2n(H2)=0.150 mol×2=0.300 mol 因为电解池A、B是串联电解池,电路中转移的电子数目相等 所以n(Fe2+)=n(e-)=0.300 mol (3)根据化学反应2Fe2++I2  2Fe3++2I-可知 2Fe3++2I-可知光催化反应生成I-的速率v(I-)=v(Fe3+)=c mol·min-1 电解池A中消耗I-的速率应等于光催化反应池中生成I-的速率 a mol·L-1×Q-b mol·L-1×Q=c mol·min-1 Q= 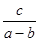 L·min-1 L·min-1点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生基础知识的巩固和训练,旨在培养学生的灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明电解池的工作原理,利用好电子的得失守恒,然后结合题意灵活运用即可。 |
相似问题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经 2 s(秒)后测得C 的浓度
升高温度 下列数据不一定增大的是 ( )A.正化学反应速率v(正)B.逆化学反应速率v(逆)C.
升高温度,下列数据不一定增大的是 ( )A.正化学反应速率v(正)B.逆化学反应速率v(逆)C.化学平衡常数KD.弱酸的电离常数Ka
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中 进行反应CO(g)+H2O
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下两组数据:实验组温度 ℃起始量
相同温度下 在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=-92 4kJ mol,实验测得起始、平衡时的有关数据如下表:下列叙述正确的
对于反应2SO2(g)+O2(g)2SO3(g) 能增大正反应速率的措施是( )A.通入大量O2B
对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是()A.通入大量O2B.增大容器容积C.移去部分SO3D.降低体系温度












