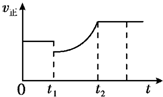
如图表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的正反应速率随时间的变化情况 试根据此
如图表示反应2SO2(g)+O2(g)?2SO3(g)△H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
 |
参考解答
| A、t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应移动,新平衡时反应物浓度比可以原来还大,平衡时正反应速率可以比原平衡速率大,故A正确. B、t1降低了温度,平衡向正反应移动,重新平衡时的速率小于原平衡速率,故B错误; C、t1时减小了压强,平衡向逆反应方向移动,重新平衡时的速率小于原平衡速率,故C错误; D、t1时增加了SO2和O2的浓度,正反应速率应大于原平衡速率,平衡向正反应方向移动,故D错误; 故选A. |
相似问题
温度 固体表面积 溶液的浓度 催化剂等都可以影响化学反应的速率 我们可以通过改变这些因素来调控反应速
温度、固体表面积、溶液的浓度、催化剂等都可以影响化学反应的速率,我们可以通过改变这些因素来调控反应速率.如:在实验室用30%左右的硫酸溶液与锌粒反
下列措施中 能减慢化学反应速率的是( )A.用MnO2作H2O2分解反应的催化剂B.把石灰石固体研
下列措施中,能减慢化学反应速率的是( )A.用MnO2作H2O2分解反应的催化剂B.把石灰石固体研细后与盐酸反应C.把盛有Cu和稀硝酸的试管浸泡在热水中D
(3分)在一定温度下 A B能在溶液中发生反应生成C和D:A+B=C+Da将0.2 mol/L A溶
(3分)在一定温度下,A、B能在溶液中发生反应生成C和D:A+B=C+Da将0 2 mol L A溶液和0 2 mol L B溶液各20ml混合b将0 5 mol L A溶液和0 5 mol L
在其他条件具备时 若一反应较难进行 则其主要原因可能是( )①参加反应的分子的能量普遍较低②参加反
在其他条件具备时,若一反应较难进行,则其主要原因可能是( )①参加反应的分子的能量普遍较低②参加反应的分子的能量普遍较高③单位时间内反应物活
实验室利用Zn和稀HCl反应制取H2 下列措施中 不能提高化学反应速率的是( )A.增大盐酸的浓
实验室利用Zn和稀HCl反应制取H2,下列措施中,不能提高化学反应速率的是()A.增大盐酸的浓度B.给反应液加热C.向溶液中加入少量硫酸铜溶液D.向溶液中












