已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1 某课外活动小组为了探
| 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体. 请回答: (1)A中的现象______,B中的现象______; (2)由此可知,降低温度,该化学平衡向______(填“正”或“逆”)反应方向移动; (3)该化学反应的浓度平衡常数表达式为______,升高温度,该反应中NO2的转化率将______(填“增大”、“减小”或“不变”). Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭. (1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深. ①推进针筒后颜色变深的原因是______; ②一段时间后气体颜色又变浅的原因是______; ③由此实验得出的结论是______. (2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是______;在此过程中,该反应的化学平衡常数将______ (填“增大”、“减小”或“不变”,下同),NO2的转化率将______. 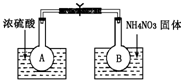 |
参考解答
| (1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,故答案为:气体颜色加深,气体颜色变浅; (2)由以上分析知,降低温度,平衡向正反应方向移动,故答案为:正; (3)Kc=
故答案为:Kc=
Ⅱ.(1)①气体的体积减小时,NO2浓度增大,则气体颜色加深, 故答案为:气体的体积减小,NO2浓度增大,气体的颜色加深; ②气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅, 故答案为:增大压强,减小气体的体积,平衡向正反应方向移动; ③增大压强,化学平衡向气态物质系数减小的方向移动,故答案为:增大压强,化学平衡向气态物质系数减小的方向移动; (2)气体体积增大,二氧化氮浓度减小,所以气体颜色变浅,同时气体的压强减小,平衡向逆反应方向移动,二氧化氮的浓度增大,但仍不如第一支针筒气体的浓度大,所以仍比第一支针筒气体的颜色浅;化学平衡常数只与温度有关,温度不变,化学平衡常数不变,平衡向逆反应方向移动,所以二氧化氮的转化率减小, 故答案为:气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅,不变,减小. |
相似问题
在1000K时 已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0.0059
在1000K时,已知反应Ni(s)+H2O(g)?NiO(s)+H2(g)的平衡常数K=0 0059.当水蒸气和氢气的物质的量浓度相等时,此反应( )A.未达平衡状态,反应
以Al(OH)3 H2SO4 工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流
以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下: 回答下列问题:(1)氧化步骤中发生的主要反应的离子方程式为___
一定温度下 在恒容容器中发生如下反应:2A(g)+B(g)2C(g) 若反应开始时充入2mol A
一定温度下,在恒容容器中发生如下反应:2A(g)+B(g)2C(g) ,若反应开始时充入2mol A、2molB达到平衡后,A的体积分数为a%。其他条件不变时,下列配比做
对于可逆反应 2SO2 (g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K 下列说法
对于可逆反应,2SO2(g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K,下列说法正确的是( )A.K值越大SO2转化率越大B.减小压强K值减小C.升
一定温度下将1mol SO3 放入2L的反应器内 当反应:2SO3(g)2SO2(g)+O2(g)
一定温度下将1molSO3放入2L的反应器内,当反应:2SO3(g)2SO2(g)+O2(g)平衡时,容器内有0 6molSO2,其平衡常数约是( )A.0 68B.0 34C.0 45D.0 47












