下列说法正确的是A.0.1 mol/L氨水与0.1 mol/L盐酸等体积混合 所得溶液中c(H+)=
下列说法正确的是
|
参考解答
| D |
| A. 0.1 mol/L氨水与0.1 mol/L盐酸等体积混合,酸碱恰好完全反应,恰好生成氯化铵,为强酸弱碱盐,溶液显酸性; B.判断溶液酸碱性最根本的衡量标准为C(H+)=C(OH-), 100 ℃时,纯水中C(H+)=C(OH-)=1×10-6 mol·L-1呈中性; C. 将pH=a的醋酸溶液稀释,溶液酸性减弱,溶液的pH变大,所以b>a。 |
相似问题
一定温度下 将一定质量的冰醋酸加水稀释过程中 溶液的导电能力变化如图所示。有关说法正确的是A.a b
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是A.a、b、c三点溶液的pH:a>b>cB.若使C点的醋酸根离子浓
向0.1 mol/L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是( )A.溶液
向0 1 mol L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是()A.溶液的导电能力减弱B.溶液的pH变小C.NH3·H2O的电离度变大D.Kw(水的离子积常数)变大
(6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖(用编号回答)其中属于弱电解质的有
(6分)下列物质:①水②醋酸③盐酸④烧碱⑤硝酸钾⑥酒精⑦汽油⑧蔗糖(用编号回答)其中属于弱电解质的有;属于强电解质的有;强电解质在水中电离。
(8分)在一定温度下 冰醋酸加水稀释过程中溶液的导电能力如图所示 请回答:(1)加水前导电能力为零的
(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:(1)加水前导电能力为零的理由是:(2)a、b、c、d四点醋酸的电离度大小顺
(12分)在稀氨水中存在下述电离平衡NH3 + H2O NH3 ·H2O NH4+ + OH— 分别
(12分)在稀氨水中存在下述电离平衡NH3 + H2O NH3 ·H2O NH4+ + OH—,分别加入少量下列物质,溶液中c ( OH—) 如何变化?(填“增大”“减小


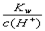 =0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1 mol/L的溶液中,Na+、CO32-、Cl-一定能大量共存









