某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中 铝表面很快出现一
| 某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。 ⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______________。 A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强 B.硫酸铜水解生成硫酸使铝钝化 C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能 D.生成氯化铝溶于水,而生成硫酸铝不溶于水 请设计一个简单实验验证你的选择:__________________。 ⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是_____________。 用离子方程式解释产生气泡的原因:_____________。 ⑶放出的气体是_______________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是_______________ 。(写出一点即可) ⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是___________________ 。 A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中 B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中 C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片 D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中 ⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下: |
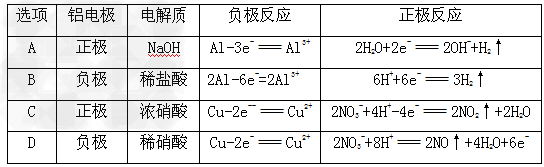 |
| 其中正确的是____________ ,由此推知,金属作电极不仅与本身性质相关,而且与 __________ 有关。 |
参考解答
| ⑴C ;在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意:不能加入盐酸),若反应明显加快了,说明上述推断正确。 ⑵2Al+3Cu2+ =3Cu+2Al3+ ;Al3+ +3H2O  Al(OH)3+3H+,Cu2+ +2H2O Al(OH)3+3H+,Cu2+ +2H2O Cu(OH)2+2H+,2Al+6H+=2Al3+ +3H2↑ Cu(OH)2+2H+,2Al+6H+=2Al3+ +3H2↑ ⑶氢气; ①随着反应进行生成铝离子浓度增大,水解程度增大,产生大量H+ ②该反应放热,升高温度反应加快 ③铜与铝构成原电池,加快铝失电子 ⑷AB ⑸B ;电解质的性质 |
相似问题
某化学学习小组利用下图所示装置来探究相应物质的化学性质的顺序。选择适当试剂完成实验A B C 并得出
某化学学习小组利用下图所示装置来探究相应物质的化学性质的顺序。选择适当试剂完成实验A、B、C,并得出相应的实验结论。实验A、B、C所用试剂或所得结论
已知稀溴水和FeCl3溶液都呈黄色。现在2mL的稀FeCl2溶液中 加入1~2滴浓溴水 振荡后溶液呈
已知稀溴水和FeCl3溶液都呈黄色。现在2mL的稀FeCl2溶液中,加入1~2滴浓溴水,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。 (1)限选用的试剂有:
某学生课外学习活动小组针对教材中铜与浓硫酸反应 提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:实验试剂:1
为探究乙烯与溴的加成反应 甲同学设计并进行了如下实验 将乙醇与浓硫酸的混合液加热至170℃ 将生成
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验,将乙醇与浓硫酸的混合液加热至170℃,将生成 气体通入溴水中,发现溴水褪色,即证明乙烯与溴水
兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧 为了确定其产物并进行实验论证 某同学
兴趣小组的学生根据Mg与CO2反应原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原得到黑色












