第四周期元素的单质及化合物在工农业生产中应用广泛。(1)第四周期元素中 基态原子的最外层只有1个电子
| 第四周期元素的单质及化合物在工农业生产中应用广泛。 (1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种。 (2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号)。
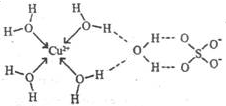 ①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 。 ②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是 ,配体是 ,配位原子是 ,配位数是 。 ③铜离子形成胆矾中配位离子的离子方程式为 。 (4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因 。 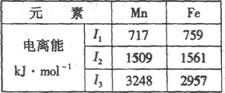 |
参考解答
| (11分)(1)3(1分) (2)C(1分) (3)①离子键;氢键 ②Cu2+,H2O,O,4(各1分) ③Cu2++4H2O=[Cu(H2O)42+(1分) (4)Mn的I3 ='3248' kJ·mo1-1大于Fe的I3='2957' kJ·mo1-1,所以Mn2+再失去电子比Fe2+更难(1分),原因是Mn2+的电子排布为[Ar3d5,属于较稳定的半充满结构,而Fe2+的电子排布为[Ar3d6,易失去1个电子形成较稳定的半充满结构。(1分) |
试题分析:(1)第四周期元素中,基态原子的最外层只有1个电子的元素中,主族元素是K,副族元素有Cr和Cu共计是3种元素。 (2)金属元素才有焰色反应,所以铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是钙离子中电子跃迁,答案选C。 (3)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键。 ②共计化学式[Cu(H2O)4SO4·H2O可知,其中中心原子(离子)是Cu2+,配体是H2O,配位原子是O原子,配位数4。 ③铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)42+,离子方程式为Cu2++4H2O=[Cu(H2O)42+。 (4)由于Mn2+的电子排布为[Ar3d5,属于较稳定的半充满结构,而Fe2+的电子排布为[Ar3d6,所以易失去1个电子形成较稳定的半充满结构。 点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力,旨在考查学生对知识的掌握与利用。 |
相似问题
有关乙炔分子中的化学键描述不正确的是 A.两个
有关乙炔分子中的化学键描述不正确的是A.两个碳原子采用sp杂化方式B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳
对下列实验现象的原因分析不正确的一项是 ( ) 选项实验现象原因分析 A浓硫化钠溶液有臭味
对下列实验现象的原因分析不正确的一项是 ()选项实验现象原因分析 A浓硫化钠溶液有臭味硫 硫离子水解生成硫化氢,硫化氢具有臭味B新新制氯水中滴加石
氢气的制取与储存是氢能源利用领域的研究热点。(1)已知:下列有关该反应的叙述正确的是A.正反应活化能
氢气的制取与储存是氢能源利用领域的研究热点。(1)已知:下列有关该反应的叙述正确的是A.正反应活化能小于169 8kJ·mol-1B.逆反应活化能一定小于169
下列说法正确的是 ①离子化合
下列说法正确的是①离子化合物含离子键,也可能含极性键或非极性键②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C③含金属元素的化合物不一定是离子化合
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:H2(g)+Cl2(g)=2HCl(g)
(1)已知反应及几种物质中化学键断裂时的能量变化如下所示:H2(g)+Cl2(g)=2HCl(g)△H=-184kJ mol4HCl (g)+O2(g)=2Cl2 (g) +2H2O (g)△H=-1












