常温下 0.1 mol/L某一元酸(HA)溶液中=1×10-8 下列叙述正确的是A.溶液中加入一定量
常温下,0.1 mol/L某一元酸(HA)溶液中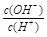 =1×10-8,下列叙述正确的是 =1×10-8,下列叙述正确的是A.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 B.溶液中c(H+)+c(A-)=0.1 mol/L C.溶液中水电离出的c(H+)=10-10 mol/L D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+) |
参考解答
| A |
常温下,水的离子积为1×10-14,结合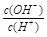 =1×10-8可得出,溶液中的 =1×10-8可得出,溶液中的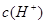 =1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA =1×10-3mol/L,可见一元酸没有完全电离,为弱酸:HA H++OH—; H++OH—;A.溶液中加入一定量CH3COONa晶体,CH3COO—会结合溶液中的H+,使溶液中的c(H+)减少,c(OH-)必定增加;加水稀释,溶液酸性减弱,c(H+)减小,c(OH-)增大,符合题意 B.由上面的分析可知,溶液中的 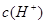 =c(A-)=1×10-3mol/L,错误 =c(A-)=1×10-3mol/L,错误C.对于一元酸溶液来说,水电离出的c(H+)等于溶液中c(OH-),即10-11mol/L,排除 D.所给离子顺序,很明显违背了电荷守恒原则,排除。 故答案为A |
相似问题
下列说法正确的是( )A.c(H+)=1×10-7mol/L的溶液一定是酸性B.水本身电离出的
下列说法正确的是()A.c(H+)=1×10-7mol/L的溶液一定是酸性B.水本身电离出的c(H+)=1×10-13的溶液,可能是0 1mol·L-1的盐酸或0 1mol·L-
下列事实不能说明亚硝酸是弱电解质的是A.NaNO2溶液的pH大于7B.向HNO2溶液中加入NaNO2
下列事实不能说明亚硝酸是弱电解质的是A.NaNO2溶液的pH大于7B.向HNO2溶液中加入NaNO2固体,溶液的PH变大C.常温下0 1mol LHNO2溶液的pH为2 1D.用HNO2
向含有下列离子的溶液中分别加少量的Na2O固体后 该离子数目能增加的是A.HS-B.COC.NHD.
向含有下列离子的溶液中分别加少量的Na2O固体后,该离子数目能增加的是A.HS-B.COC.NHD.NO
弱电解质的电离程度可用电离度()表示: 现有pH均为4的HCl和溶液 则两种溶液中H2O的电离度之比
弱电解质的电离程度可用电离度()表示:,现有pH均为4的HCl和溶液,则两种溶液中H2O的电离度之比为( )A.1:2B.2:5C.1:106D.106:1
一定温度下 用水稀释c mol·L-1的稀醋酸 若用KW表示水的离子积 则下列数值随水量的增加而增大
一定温度下,用水稀释c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是()A.c(CH3COO-) c(CH3COOH)B.c(CH3COOH) c(H












