在硫酸工业中 SO2转化为SO3是一个关键步骤.(1)SO2有氧化性又有还原性 还有漂白性.将SO2
| 在硫酸工业中,SO2转化为SO3是一个关键步骤. (1)SO2有氧化性又有还原性,还有漂白性.将SO2氧化通入酸性KMnO4溶液中,溶液褪色,SO2表现______性,其中氧化剂和还原剂物质的量之比为______(已知KMnO4酸性条件下的还原产物为Mn2+). (2)某温度下,SO2(g)+
(3)下列关于2SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1反应的如图1图象中,错误的是______. 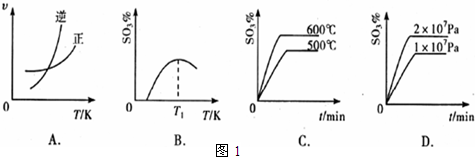 (4)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是______(填字母). A.保持温度和容器体积不变,充入2 mol SO3 B.保持温度和容器体积不变,充入2 mol N2 C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2 D.保持容器体积不变,升高混合气体温度 E.移动活塞压缩气体 (5)某人设想以如图2装置生产硫酸,写出a电极的电极反应式______.检验SO42-的具体操作为______. 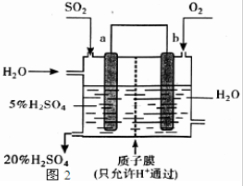 |
参考解答
| (1)SO2气体通入酸性KMnO4中,酸性KMnO4褪色,高锰酸钾中锰元素是最高价具有氧化性,二氧化硫具有还原性;Mn元素化合价由+7价降低到+2价,化合价变化5价,S元素化合价由+4价升高到+6价,化合价变化2价,氧化还原反应中氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂物质的量之比为2:5, 故答案:还原;2:5; (2)SO2(g)+
SO2(g)+
起始 4.0mol 10.0mol 0 转化 2.0mol 1.0mol 2mol 平衡 2.0mol 9.0mol 2mol 则平衡时:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L, 所以k=
故答案为:3.33; (3)A.升高温度,逆反应速率增大更多,平衡向逆反应方向移动,图象与实际符合,故A正确; B.升高温度,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际符合,故B正确; C.升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际不符,故C错误; D.增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,图象与实际符合,故D正确; 故答案为:C; (4)A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确; B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误; C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2,平衡向正反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故C正确; D.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故D错误; E.移动活塞压缩气体,体积减小,各物质的浓度都增大,故E正确. 故答案为:ACE; (5)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸,电极反应为:SO2+2H2O-2e-=SO42-+4H+;检验硫酸根离子的方法为:取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀说明溶液中含SO42-, 故答案为:SO2+2H2O-2e-=SO42-+4H+;取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液. |
相似问题
在一定条件下 发生如下反应:;(1)该反应中的含义是(填序号):___________。①该反应达到
在一定条件下,发生如下反应:;(1)该反应中的含义是(填序号):___________。①该反应达到平衡时放出的热量 ②该反应达到平衡时吸收的热量③该条件下
在1L密闭容器中通入2mol氨气 在一定温度下发生反应:2NH3 N2+3H2 达平衡时 N2的物质
在1L密闭容器中通入2mol氨气,在一定温度下发生反应:2NH3 N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g) Fe(s)+CO2(g)(正反应为吸热反应)
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g) Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数为0 263。若在1100℃时,测得高炉
一定温度下 对于反应2A(g)+B(g) 2C(g)在反应过程中C的物质的量n(C)随着时间变化关系
一定温度下,对于反应2A(g)+B(g)2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如下图所示,现从t1时间开始对反应体系升高温度,n(C)的变
下图是可逆反应X + YZ 在反应过程中的反应速率(v)与时间(t)的关系曲线 下列叙述正确的是[
下图是可逆反应X+YZ在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是[ ]A.t1时,只有正方向反应 B.t2时,达到该条件下的反应限












