在体积固定的密闭容器中 进行如下化学反应:N2O4(g)2NO2(g) 其化学平衡常数K和温度t的关
在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表: 2NO2(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题: (1)该反应的化学平衡常数表达式K= 。 (2)该反应为 反应(填“吸热”或“放热”)。 (3)判断该反应达到化学平衡状态的依据是 。 A.容器内混合气体密度不变 B.混合气体中c(NO2)不变 C.0.5mol N2O4分解的同时有1 mol NO2生成 (4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
①b的值为 ; ②N2O4的平衡转化率为 ; ③20s~40s内用N2O4表示的平均反应速率υ(N2O4)= 。 |
参考解答
(1)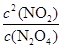 (1分) (2) 吸热(2分) (3) B (2分) (1分) (2) 吸热(2分) (3) B (2分)(4)①1.60 (2分) ②42.9% 或0.429(2分) ③0.008 mol·L-1·S-1(2分) |
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K= 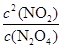 。 。(2)根据表中数据可知,随着温度的升高,平衡常数逐渐增大。这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应。 (3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变,所以容器内混合气体密度不变不能说明反应达到平衡状态,A不正确;B、混合气体中c(NO2)不变可以说明反应得到平衡状态,B正确;C、根据反应式可知,0.5mol N2O4分解的同时一定有1 mol NO2生成,所以不能说明反应达到平衡状态,C不正确,答案选B。 (4)①根据表中数据可知,反应进行到20s时NO2的物质的量是0.96mol所以消耗N2O4的物质的量是0.96mol÷2=0.48mol,则剩余N2O4的物质的量=2.80mol-0.48mol=2.32mol,即A=2.32mol。从20s进行到40s消耗N2O4的物质的量=2.32mol-2.00mol=0.32mol,所以生成NO2的物质的量=0.32mol×2=0.64mol,则b=0.96mol+0.64mol=1.60mol,即b=1.60mol。 ②根据表中数据可知,反应进行到80s时NO2的物质的量不再发生变化,说明反应达到平衡状态,此时消耗N2O4的物质的量=2.40mol÷2=1.20mol,所以N2O4的转化率= 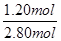 ×100%=42.9%。 ×100%=42.9%。③20s~40s内消耗N2O4的浓度=0.32mol÷2L=0.16mol/L,所以用N2O4表示的平均反应速率υ(N2O4)=0.16mol/L÷20s=0.008 mol·L-1·S-1。 |
相似问题
下列事实不能用勒夏特列原理解释的是[ ]A.打开汽水瓶时 有大量气泡溢出 B.对2HI(g)
下列事实不能用勒夏特列原理解释的是[ ]A.打开汽水瓶时,有大量气泡溢出 B.对2HI(g)H2(g)+I2(g),增大平衡体系压强可使颜色变深 C.在合成氨的反应
下列事实不能用勒夏特列原理解释的是 [ ]A.黄绿色的氯水光照后颜色变浅B.在硫酸亚铁溶液中
下列事实不能用勒夏特列原理解释的是 [ ]A.黄绿色的氯水光照后颜色变浅B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质 C.生产硝酸的过程中使用过量空
已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下
已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如
把6molA和5molB两气体通入容积为4L的密闭容器中 一定条件下反应:3A(g)+ B(g) 2
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+ B(g) 2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应
下列现象不能用勒夏特列原理解释的是 [ ]A.向血红色的Fe(SCN)3溶液中加入少量KSC
下列现象不能用勒夏特列原理解释的是 [ ]A.向血红色的Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深 B.合成氨工业中选择较大压强和较高温度以提高N