(16分)合成氨技术的发明使工业化人工固氮成为现实。(1)已知N2(g)+3H2(g)2NH3(g)
| (16分)合成氨技术的发明使工业化人工固氮成为现实。 (1)已知N2(g)+3H2(g) 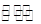 2NH3(g) 2NH3(g) 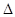 H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。 H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知: 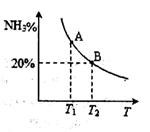 ①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。 ②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。 (3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) 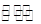 H2O(1)+CO(NH2)2(1) △H, H2O(1)+CO(NH2)2(1) △H,在一定压强下测得如下数据: 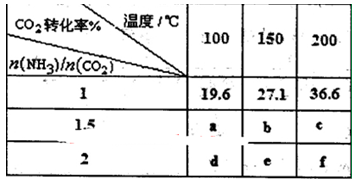 ①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。 ②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。 |
参考解答
| (16分) (1)69.15kJ(2分) (2)① >(1分) 向左(1分) ②0.09 mol·L-1·min-1(2分) 向右(2分) (3)①>(2分) < (2分) <(2分) ②净化后重新充入合成塔内,循环利用,提高原料利用率(2分) |
试题分析:(1)标准状况下33.6LNH3物质的量为:33.6L÷22.4L/mol=1.5mol,92.2kJ·mol-1÷2×1.5mol=69.15kJ。 (2)①根据图像,B点NH3的百分含量小于A点NH3的百分含量,所以K1 > K2;若在恒温、恒压条件下,向平衡体系中通入氦气,原反应体系气体的压强减小,平衡向气体系数增大的方向移动,即向左移动。 ②根据“三段式”进行计算,设N2转化浓度为X,则 N2(g)+3H2(g)  2NH3(g) 2NH3(g)起始浓度(mol?L ̄1) 2.1 1.5 0 转化浓度(mol?L ̄1) X 3X 2X 平衡浓度(mol?L ̄1)2.1—X 1.5—3X 2X 根据T1时NH3的百分含量为20%,则2X/(2.1—X+1.5—3X+2X)=20%,解得X=0.3,则v(H2)=0.9mol/L÷10min='0.09' mol·L-1·min-1;根据平衡浓度可求平衡常数K=(0.6mol?L ̄1)2÷[1.8mol/L×(0.6mol?L ̄1)3=0.93(mol?L ̄1)-2,再向该容器内通入N2、H2、NH3各0.4mol,则Q=(1mol?L ̄1)2÷[2.2mol/L×(1mol?L ̄1)3=0.45(mol?L ̄1)-2,Q < K,所以平衡向右移动。 (3)①根据表中数据,温度升高,CO2的转化率增大,平衡向右移动,所以正反应为吸热反应,?H > 0;n(NH3)/n(CO2)增大,CO2的转化率增大,所以a < d,b <f。 ②CO2、NH3为反应物,所以净化后重新充入合成塔内,循环利用,提高原料利用率。 |
相似问题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢 设计了如下图1所示的装置。(1)
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。(1)检查图1所示装置气密性的方法是____________________。
在一定条件下 在容积为2L的密闭容器中 将2mol气体M和3mol气体N混合 发生如下反应:2M(
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g) x Q(g)+3R(g),经2min达平衡,生成2 4molR,并测
下列关于能量转换的认识中不正确的是( )A.煤燃烧时 化学能主要转化为热能B.电解水生成氢气和氧气
下列关于能量转换的认识中不正确的是( )A.煤燃烧时,化学能主要转化为热能B.电解水生成氢气和氧气时,电能转化为化学能C.白炽灯工作时,电能全部
下列有关能量转换的说法正确的是( )A.氢氧燃烧电池是将化学能转化为热能的过程B.化石燃料和植物燃
下列有关能量转换的说法正确的是( )A.氢氧燃烧电池是将化学能转化为热能的过程B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能C.动物体内葡
下列说法中错误的是( )A.化学反应必然伴随着能量变化B.能量变化是化学反应的基本特征之一C.化学
下列说法中错误的是( )A.化学反应必然伴随着能量变化B.能量变化是化学反应的基本特征之一C.化学反应中能量变化的大小与反应物的质量多少无关D.












