(10分)固定和利用CO2能有效地利用资源 并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃
(10分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标. CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是___________ ,该时间段内H2的平均反应速率是_____________。 (2)平衡时CO2的转化率是多少?反应前后容器内的压强比时多少?(请按计算题格式在答题卡上作答) L) 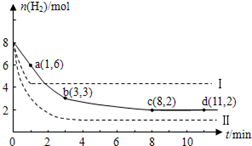 |
参考解答
| (1)0~a段;该时间段内H2的平均反应速率是1mol/(L·min) (2)33% ;7︰5 |
试题分析:(1)0~a段:V(H2)='(8mol-6mol)÷2L÷1min=1mol/(L·min);' a~b段:V(H2)='(6mol-3mol)÷' 2L÷ 2min='0.75mol/(L·min);' b~c段:V(H2)='(3mol-2mol)÷2L÷5min=0.1mol/(L·min);' c~d段:V(H2)='(2' mol- 2mol)÷2L÷5min0=0.1mol/(L·min)。所以平均反应速率最大的时间段是0~a段。该时间段内H2的平均反应速率是1mol/(L·min)。(2) 在反应过程中H2的物质的量改变6mol,因为CO2与H2反应的物质的量的比为1:3,所以CO2反应消耗的物质的量为2mol.因此平衡时CO2的转化率是(2mol÷6molCO2) ×100%= 33%。反应前后容器内的压强比等于气体的物质的量的比。在反应开始时,n(总)=6+8=14mol;当反应达到平衡时,n(H2)=2mol;n(CO2)=(6-2)mol=4mol;n(CH3OH)=2mol;n(H2O)= 2mol。所以n(总)平衡=10mol.n(开始):n(平衡)=14:10=7︰5。所以反应前后容器内的压强比7︰5。 |
相似问题
对于在密闭容器中发生的化学反应N2+3H32NH3已达平衡 如果保持其他条件不变 只增加N2的浓度
对于在密闭容器中发生的化学反应N2+3H32NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则()A.只有正反应速率增大B.逆反应速率减小C.正逆反
下列关于化学反应速率的说法中错误的是A.反应速率用于衡量化学反应进行快慢B.决定化学反应速率的主要因
下列关于化学反应速率的说法中错误的是A.反应速率用于衡量化学反应进行快慢B.决定化学反应速率的主要因素是反应物的本质C.可逆反应达到平衡状态时正逆
.对于反应2A(g)+B(g)=3C(g)+5D(g) 在某段时间内的平均反应速率为 (x代表某反应
对于反应2A(g)+B(g)=3C(g)+5D(g),在某段时间内的平均反应速率为,(x代表某反应物或生成物)之间的关系,正确的是( ) A.B. C. D.
在2L密闭容器中进行如下反应: 5min内氨的质量增加了1.7g 则反应速率为( )A.B.C.
在2L密闭容器中进行如下反应:,5min内氨的质量增加了1.7g,则反应速率为()A.B.C.C.
向2.0L恒容密闭容器中充人1.0mol PCl5 在温度为T时发生如下反应PCl5(g) PCl3
向2 0L恒容密闭容器中充人1 0mol PCl5,在温度为T时发生如下反应PCl5(g) PCl3(g)+C12(g)H=124kJ·mol-1。反应过程中测定的部分数据见下表:时间t s0501












