影响化学反应速率的因素很多 某校化学小组用实验的方法进行探究。实验药品:铜 铁 镁 0.5mol/L
| 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4 A:甲同学研究的实验报告如下表:
(2)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。B:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验 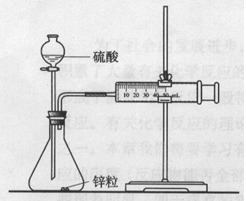 (3)乙同学在实验中应该测定的数据是 。 (4)乙同学完成该实验应选用的实验药品 。该实验中不选用某浓度的硫酸,理由是 。 |
参考解答
| (1)分别投入大小、形状相同的铜、铁、镁 (2)研究金属本身的性质与反应速率的关系 温度相同 (3)一定时间内产生气体的体积(或产生一定体积的气体所需的时间) (4)镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4 常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同。18.4mol/LH2SO4使铁钝化 |
试题分析:(1)要比较不同的金属与硫酸反应的快慢时,三种金属的大小、形状相同应该是相同的,即答案应该是分别投入大小、形状相同的铜、铁、镁。 (2)由于三种金属是不同的,所以实验目的是研究金属本身的性质与反应速率的关系。比较不同的金属与硫酸反应的快慢时,处理硫酸的浓度、固体的表面积相同以外,溶液的温度应该是相同的。 (3)要比较浓度不同的硫酸与同一种金属反应的反应速率快慢,可以通过测量一定时间内产生气体的体积(或产生一定体积的气体所需的时间)。 (4)由于是比较不同浓度的硫酸与金属反应的快慢,所以选择的试剂应该是镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4。由于常温下,镁与18.4mol/LH2SO4反应产生SO2,使对比实验的反应原理不同,而18.4mol/LH2SO4使铁钝化,所以不能选择浓硫酸。 点评:探究性实验的一般思路 1、准确地把握实验目的。 2、利用已学知识,分析如何实现这个目的--实验原理。 3、结合实验材料,初步确定设计对策--实验方案。 |
相似问题
对于可逆反应:2SO2 + O2 2SO3(g) △H<0 升高温度产生的影响为()A.v正增大
对于可逆反应:2SO2 + O22SO3(g)△H<0,升高温度产生的影响为()A.v正增大, v逆减小B.v正减小, v逆增大C.v正和v逆不同程度的增大D.v正和v逆同等程度的增大
为探究锌与稀硫酸的反应速率(以v(H2)表示) 向反应混合液中加入某些物质 下列判断正确的是A.加入
为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是A.加入NH4HSO4固体,v(H2)不变B.加入少量水,v(H2)减小C.加
下列说法正确的是( )A.对于有气体参加的化学反应来说 增大压强 可使活化分子百分数增多 化学
下列说法正确的是()A.对于有气体参加的化学反应来说,增大压强,可使活化分子百分数增多,化学反应速率一定增大B.升高温度,活化分子百分数不变,但
下列关于催化剂的说法正确的是A.使用催化剂可以增大正反应速率 减小逆反应速率B.使用催化剂可以使化学
下列关于催化剂的说法正确的是A.使用催化剂可以增大正反应速率,减小逆反应速率B.使用催化剂可以使化学平衡向正反应方向移动C.使用催化剂可以降低反应
下列说法正确的是A.所有放热反应均是自发反应 也是熵增大的反应B.向AgCl固液混合物中滴入KI饱和
下列说法正确的是A.所有放热反应均是自发反应,也是熵增大的反应B.向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶












