硫酸用途十分广泛 工业上合成硫酸时 将SO2转化为催化氧化是一个关键步骤。请回答下列问题:(1)该反
| 硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题: (1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母) a.SO2和SO3浓度相等 b.SO2百分含量保持不变 c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等 e.容器中混合气体的密度保持不变 (2)某温度下,2SO2(g)+O2(g)  2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 (3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。 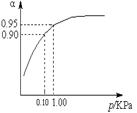 (4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。) |
参考解答
(1)bc (2)0.036 17.64 (3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。 (4)94.7% |
试题分析:(1)“变量不变达平衡”,a。反应物和生成物的浓度不变时达平衡,而不是相等,错误;b。SO2百分含量是变量,不变时达到平衡,正确;c.反应是在恒容的容器中进行,反应前后气体的物质的量会发生变化,故容器中气体的压强是变量,正确; d.SO3的生成速率与SO2的消耗速率是同一个方向,一定相等,错误;e.容器体积固定,气体的质量固定,气体的密度是定量,错误; (2)v(O2)=v (SO3)/2=0.18÷5÷0.5÷2=0.036mol?L-1?min-1,放出的热量为196÷2×0.18=17.64kJ; (3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。 (4)通过过量NaOH溶液,被吸收的为SO2和SO3,物质的量为21.28÷22.4=0.95mol;剩余氧气的量为5.6÷22.4=0.25mol,反应的氧气为0.7-0.25=0.45mol,生成SO3的量为0.45×2=0.9mol;故剩余SO2的量为0.95-0.9=0.05mol,其始量为0.95+0.05=1.00mol,转化率为0.95÷1.00=0.95 |
相似问题
某化学反应2A(g)B(g)+D(g)在四种不同条件下进行 B D起始浓度为0。反应物A的浓度(mo
某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol L)随反应时间(min)的变化情况如下表:实验序号时间浓度温度010203
在密闭容器中 发生反应2A(g)+B(g)3C(g)+4D(g) 下列情况能够降低该反应速率的是(
在密闭容器中,发生反应2A(g)+B(g)3C(g)+4D(g),下列情况能够降低该反应速率的是()A.缩小容器体积B.加入催化剂C.降低温度D.增加气体A的用量
在一定温度下 将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中 发生如下反应:3
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成了0 8m
要增大锌与盐酸反应的速率 所采取的下列措施无效的是 ( )A.增大盐酸的浓度B.提高反应的温度
要增大锌与盐酸反应的速率,所采取的下列措施无效的是 ()A.增大盐酸的浓度B.提高反应的温度C.用锌粉代替锌片D.用纯锌代替粗锌
在某一化学反应中 反应物B的浓度在5 s内从2.5 mol/L变成0.5 mol/L 在这5 s内B
在某一化学反应中,反应物B的浓度在5 s内从2 5 mol L变成0 5 mol L,在这5 s内B的化学反应速率为()A.0 4 mol LB.0 4 mol L·sC.0 4mol-1·L-1·s-1D.0 4 mol (L·s)












