室温下 0.1mol/L的醋酸溶液的PH约为3 当向其中加入醋酸钠晶体溶解后发现溶液的PH变大 对上
| 室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。 (1)上述解释中 (填“甲”或“乙”)正确。 (2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断: ①溶液中共有 种粒子 ②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是 和 ③溶液中n(CH3COO-)+ n(OH-)-n(H+)= |
参考解答
| (1)乙⑵ B ⑶乙、增大 ⑷① 7 ②CH3COO- CH3COOH ③0.006mol |
(1)(2)(3)由题意知,溶液中存在两个平衡:CH3COOH 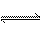 CH3COO-+H+,CH3COO-+H2O CH3COO-+H+,CH3COO-+H2O CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。 CH3COOH+OH-。醋酸溶液中加入醋酸钠晶体,溶液的pH虽然增大,但只会小于7。因此CH3COOH的电离平衡占主导地位,乙同学的解释正确。为了验证两种解释哪种正确,就得选择一种含有CH3COO-但水解不显碱性的物质再实验,它只能是CH3COONH4。(4)混合溶液中存在反应有:CH3COONa+HCl====NaCl+CH3COOH,NaCl====Na++Cl-, CH3COOH  CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。 CH3COO-+H+,H2O=====H++OH-。因此,溶液中存在Na+、Cl-、CH3COOH、CH3COO-、H2O、H+、OH-等7种粒子。根据物料守恒,n(CH3COOH)+n(CH3COO-)=n(Na+)=0.010mol,根据电荷守恒,n(CH3COO-)+c(OH-)+c(Cl)-=n(Na+)+n(H+),因此,n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol。 |
相似问题
(12分)明矾水溶液呈____性 原因是_ __
(12分)明矾水溶液呈____性,原因是___;(用离子方程式说明)。碳酸钠水溶液呈____性,原因是___.(用离子方程式说明)。把上述两溶液混合后呈现的现
(12分)在常温下 下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COON
(12分)在常温下,下列五种溶液:①0 1mol L NH4Cl②0 1mol L CH3COONH4③0 1mol L NH4HSO4④0 1mol L NH3·H2O和 0 1mol L NH4Cl混合液⑤0 1mol
下列关系的表述中 正确的是 ( ) A.0.1 mol/L NaHSO4溶液中:c(Na+
下列关系的表述中,正确的是( )A.0 1 mol L NaHSO4溶液中:c(Na+)+c(H+)=c(SO42—)+c(OH-)B.中和pH和体积都相同的盐酸和醋酸,消耗Na
在允许加热的条件下 只用一种试剂就可鉴别NH4Cl (NH4)2SO4 NaCl Al2(SO4)3
在允许加热的条件下,只用一种试剂就可鉴别NH4Cl、(NH4)2SO4、NaCl、Al2(SO4)3和Fe2(SO4)3溶液,该试剂可能是A.Ba(OH)2溶液B.AgNO3溶液C.NaOH溶液D.BaCl2溶液
下列物质溶解于水时 电离出的阴离子能使水的电离平衡向右移动的是( )A.Na2SO4B.CH3C
下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是()A.Na2SO4B.CH3COONaC.NH4ClD.HClO












