(14分)甲醇被称为2l世纪的新型燃料 工业上通过下列反应Ⅰ和Ⅱ 用CH4和H2O为原料来制备甲醇。
| (14分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。 (1)将1 mol CH4和2 mol H2O(g)通入反应室(容积为100L),并在一定条件下发生如下反应:CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ CO(g)+3H2(g)……Ⅰ测得CH4的转化率与温度、压强的关系如图。 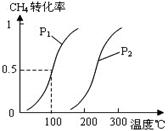 ①当压强为P1,温度为100℃时达到平衡所需的时间为5min。则用H2表示0~5min内的平均反应速率为______。 ②图中的P1_________P2(填“<”、“>”或“=”)。 ③100℃时该反应的平衡常数为______________。 ④在其它条件不变时降低温度,反应Ⅰ的逆反应速率将________(填“增大” “减小”或“不变”),反应_________移动(填“向正方向”、“向逆方向”或“不”)。 (2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇,其反应如下:CO(g)+2H2(g)  CH3OH(g)……Ⅱ CH3OH(g)……Ⅱ①则该反应的△H________0,△S_________0(填“<”、“>”或“=”)。 ②若容器容积不变,下列措施可增加甲醇产率的是___________。 A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大 ③为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。请在下表空格中填入剩余的实验条件数据。
|
参考解答
(1)①0.003mol·L-1·min-1 ②< ③2.25×10-4 ④减少 向逆反应方向 (2)①< < ②B ③
|
| (1)①当压强为P1,温度为100℃时用H2表示0~5min内的平均反应速率为0.003mol·L-1·min-1 ②在相同温度下,P1甲烷的转化率大于P2甲烷的转化率,对于此可逆反应,增大压强,平衡左移,甲烷的转化率降低,所以,图中的P1<P2 ③根据可逆反应三步走,计算出平衡时各物质的浓度,让平衡时生成物浓度幂的乘积除以反应物浓度幂的乘积,可求出平衡常数K=2.25×10-4 ④降低温度,反应Ⅰ的逆反应速率将减小,根据图像,升温,甲烷的转化率增大,平衡右移,正反应是吸热反应,所以,降温,平衡向逆反应方向移动。 (2)则该反应的△H<0,△S<0 ②增加甲醇产率的是使平衡左移,能左移的只有B。 ③填入的条件如下:
|
相似问题
下列过程没有破坏化学键的是A.2O3=3O2B.干冰升华C.NaCl晶体受热融化D.HCl气体溶于水
下列过程没有破坏化学键的是A.2O3=3O2B.干冰升华C.NaCl晶体受热融化D.HCl气体溶于水
下列物质中含有共价键的离子化合物是 A.Na2O2B.Mg
下列物质中含有共价键的离子化合物是A.Na2O2B.MgCl2C.HClD.Cl2
关于化学键的下列叙述中正确的是A.化学键存在于相邻原子之间 是一种强相互引力作用B.化学键可存在于不
关于化学键的下列叙述中正确的是A.化学键存在于相邻原子之间,是一种强相互引力作用B.化学键可存在于不同种元素的原子之间,也可存在于同种元素的原子
含有非极性共价键的化合物是A.CO2B.CaCl2C.C2H6D.NaOH
含有非极性共价键的化合物是A.CO2B.CaCl2C.C2H6D.NaOH
有下列五种说法:①相邻原子间强烈的相互作用 叫做化学键;②两个非金属原子间不可能形成离子键;③非金属
有下列五种说法:①相邻原子间强烈的相互作用,叫做化学键;②两个非金属原子间不可能形成离子键;③非金属原子间不可能形成离子化合物;④离子化合物中












