将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧 生成固态三氧化二硼和液态水 放出649.
| 将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。 |
参考解答
B2H6(g)+3O2(g) 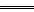 B2O3(s)+3H2O(l);ΔH='-2165' kJ·mol-11016.5 B2O3(s)+3H2O(l);ΔH='-2165' kJ·mol-11016.5 |
0.3mol乙硼烷完全燃烧生成液态水放出649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为:1 mol×649.5kJ/0.3 mol='2' 165 kJ。因此乙硼烷燃烧的热化学反应方程式为:B2H6(g)+3O2(g) 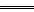 B2O3(s)+3H2O(l);ΔH=2165kJ·mol-1。由于1 mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:3mol×44 kJ·mol-1=132kJ,所以1 mol乙硼烷完全燃烧产生气态水时放热:2 165kJ-132kJ=2033kJ,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出的热量是:0.5mol×2 033kJ·mol-1=1016.5kJ。 B2O3(s)+3H2O(l);ΔH=2165kJ·mol-1。由于1 mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:3mol×44 kJ·mol-1=132kJ,所以1 mol乙硼烷完全燃烧产生气态水时放热:2 165kJ-132kJ=2033kJ,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出的热量是:0.5mol×2 033kJ·mol-1=1016.5kJ。 |
相似问题
已知1g氢气完全燃烧生成水蒸气时放出热量121 kJ 且氧气中1molO=O键完全断裂时吸收热量49
已知1g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1molO=O键完全断裂时吸收热量496 kJ,水蒸气中1 molH-O键形成时放出热量463 kJ,则氢气中1
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中 破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2 kJ,形
已知破坏1 mol H-H键 Cl-Cl键 H-Cl键分别需要吸收436 kJ 243 kJ 432
已知破坏1 mol H-H键,Cl-Cl键,H-Cl键分别需要吸收436 kJ,243 kJ,432 kJ的能量,则由H2与Cl2生成1 mol HCl的总过程需要[ ]A.放热185 kJ B.吸热185 kJC.放热92 5 kJD.吸热92 5 kJ
白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P
白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P===O c kJ·mol-1
在下列各组化合物中 化学键的类型完全相同的是( )A.HI NaIB.F2 NaBrC.H2S C
在下列各组化合物中,化学键的类型完全相同的是( )A.HI、NaIB.F2、NaBrC.H2S、CO2D.Cl2、CCl4












