工业上用硫碘开路循环联产氢气和硫酸的工艺流程如图所示:请回答下列问题:(1)在反应器中发生反应的化学
工业上用硫碘开路循环联产氢气和硫酸的工艺流程如图所示: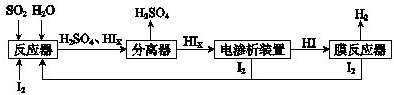 请回答下列问题: (1)在反应器中发生反应的化学方程式是______. (2)在膜反应器中发生反应:2HI(g)?H2(g)+I2(g)△H>0.若在一定条件密闭容器中加入1mol HI(g),n(H2)随时间(t)的变化关系如图1所示: ①该温度下,反应平衡常数K=______,若升高温度,K值将______(填“增大”、“减小”或“不变”). ②用化学平衡原理解释使用膜反应器及时分离出H2的目的是______. (3)电渗析装置如图2所示:  ①结合电极反应式解释阴极区HIx转化为HI的原理是______. ②该装置中发生的总反应的化学方程式是______. (4)上述工艺流程中循环利用的物质是______. |
参考解答
| (1)由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+x I2+2H2O═H2SO4+2HIX,故答案为:SO2+x I2+2H2O═H2SO4+2HIX; (2)①由图1可知,平衡时氢气的物质的量为0.1mol,则: 2HI(g)?H2(g)+I2(g) 开始(mol):1 0 0 变化(mol):0.2 0.1 0.1 平衡(mol):0.8 0.1 0.1 由于反应前后气体的物质的量不变,故可以利用物质的量代替浓度计算平衡常数,故k=
该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡常数增大, 故答案为:
②使用膜反应器及时分离出H2,使平衡正向移动,提高HI的分解率,故答案为:使平衡正向移动,提高HI的分解率; (3)①由图2可知,在阴极区Ix-转化为I-,发生反应:Ix-+(x-1)e-═xI-,且阳极区的H+通过交换膜进入阴极区,得以生成HI溶液, 故答案为:在阴极区发生反应:Ix-+(x-1)e-═xI-,且阳极区的H+通过交换膜进入阴极区,得以生成HI溶液; ②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI, 故答案为:2HIx═(x-1)I2+2HI; (4)由工艺流程可知,电渗析装置与膜反应器中都产生I2,可以在反应器中循环利用,故答案为:I2. |
相似问题
下列关于平衡常数的说法中 正确的是( )A.在平衡常数表达式中 反应物浓度用起始浓度表示 生成物浓
下列关于平衡常数的说法中,正确的是( )A.在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示B.化学平衡常数较大的可逆反
已知H2(g)+I2(g)2HI(g) △H
已知H2(g)+I2(g)2HI(g) △H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0 1 mol,乙中加入HI 0 2mol,相同温度下分别达到平衡。欲使甲中HI
对化学反应速率与化学反应限度的叙述 不正确的是[ ]A.任何可逆反应都有一定的反应限度B.反
对化学反应速率与化学反应限度的叙述,不正确的是[ ]A.任何可逆反应都有一定的反应限度B.反应温度是影响化学反应速率的决定性因素C.化学反应的限度影
在一定条件下 将3molN2和3molH2充入一个容积固定的密闭容器中 发生反应 N2(g)+3H2
在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中,发生反应,N2(g)+3H2(g)?2NH3(g),当反应达到平衡时NH3为nmol,在与上述完全相同的
一定温度下 在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g) 若反应开始时充入2 mol
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a% 其他条件不变时,若按下列四种












