面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常
| 面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质。其中过氧化钙(CaO2) 在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂。已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成。有人提出: CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。 实验一:通过测量气体的体积判断发生的化学反应,实验装置如下 |
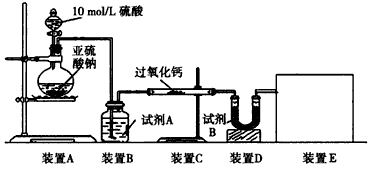 |
| (1)试剂A可以选用____________,试剂B的作用是__________。 (2)装置E用于测定氧气的体积,请在方框中画出装置图。 (3)实验测得装置C中过氧化钙质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1 关系式。未被氧化:__________,部分被氧化:__________, 完全被氧化:__________。若SO2完全被氧化,写出反应的化学方程式:___________________________。 实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。 (4)提出假设: 假设1:反应后固体中只有_______________,证明SO2未被氧化; 假设2:反应后固体中只有_______________,证明SO2完全被氧化; 假设3:____________________。 实验探究: (5)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:___________________________。 实验评价: (6)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:__________。 |
参考解答
| (1)浓硫酸;吸收未反应的SO2 |
(2)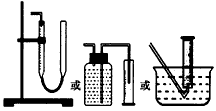 |
| (3)V=7m1/30;0<V<7m1/30;V=0;CaO2+SO2=CaSO4 (4)假设1:Na2SO3;假设2:Na2SO4;假设3:固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化 (5)取反应后的固体放入试管中,加少量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化 (6)若Na2O2有剩余,固体加水溶解时,过氧化钠能将SO32-氧化成SO42-,检验出SO42-时不能说明其是过氧化钠与SO2反应生成的 |
相似问题
某同学用下图所示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。 a.向广口瓶内注入足量热NaOH
某同学用下图所示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。 a.向广口瓶内注入足量热NaOH溶液,将盛有a g纯铁粉的小烧杯放入瓶中。b.关闭
“碘钟”实验中 3I-+ S2O32- = I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶
“碘钟”实验中,3I-+ S2O32- = I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃
Fe Cu都是人类最早使用的金属 某校化学研究性学习小组的同学运用实验的手段研究Fe Cu以及化合物
Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题(1)甲同学为
某学生为了探究锌与盐酸反应过程中的速率变化 他在100mL稀盐酸中加入足量的锌粉 用排水集气法收集反
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成
某研究性学习小组对某工业城市的空气污染进行了下列研究:(1)小组一同学分析“空气质量日报”后初步得出
某研究性学习小组对某工业城市的空气污染进行了下列研究:(1)小组一同学分析“空气质量日报”后初步得出结论,该城市空气污染的主要原因有: A.使用石












