2006年世界锂离子电池总产量超过25亿只 锂电池消耗量巨大 对不可再生的金属资源的消耗是相当大的
| 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题.某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下: 已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g. 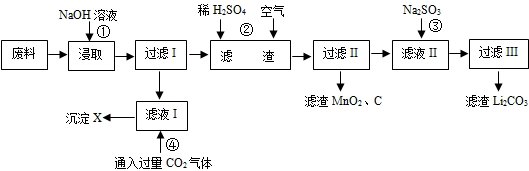 (1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是______. (2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______. (3)写出反应④生成沉淀X的离子方程式:______. (4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:______. (5)生成Li2CO3的化学反应方程式为______.已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______. |
参考解答
| 第一步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第二步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第三步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后一步加入碳酸钠之后所得的滤液主要成分为硫酸钠; (1)粉碎废料,能增大废料与氢氧化钠溶液的接触面积,加快反应速率,故答案为:增大接触面积,加快反应速率. (2)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分; (3)四羟基合铝酸钠与过量二氧化碳反应得产物是Al(OH)3沉淀和碳酸氢钠,所以离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-, 故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-. (4)在酸性环境下,LiMn2O4能被空气中的氧气氧化,生成二氧化锰、硫酸锂和水,所以化学方程式为:4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O, 故答案为:4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O; (5)硫酸锂和碳酸钠反应生成硫酸钠和碳酸锂沉淀,化学反应方程式为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤, 故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤. |
相似问题
下列能检验酒精中是否含有水的试剂是( )A.醋酸B.金属钠C.碳酸钙D.无水硫酸铜
下列能检验酒精中是否含有水的试剂是( )A.醋酸B.金属钠C.碳酸钙D.无水硫酸铜
制取下列物质的方案能够达到目的是( )A.用食盐 二氧化锰和稀H2SO4共热制Cl2B.用碳酸钠与
制取下列物质的方案能够达到目的是( )A.用食盐、二氧化锰和稀H2SO4共热制Cl2B.用碳酸钠与稀H2SO4反应制CO2C.用生锈的废钢铁与稀H2SO4反应制绿矾D
下列各组物质 不用任何试剂即可鉴别开来的是( )A.NaCl NaBr KI三种无色溶液B.HCl
下列各组物质,不用任何试剂即可鉴别开来的是( )A.NaCl、NaBr、KI三种无色溶液B.HCl、NaCl、NaNO3、Na2CO3四种溶液C.NaBr、HCl、KCl三种溶液D.
“绿色化学”是当今社会提出的一个新概念.在绿色化学工艺中 理想状态是反应中原子全部转化为欲制的产物
“绿色化学”是当今社会提出的一个新概念.在绿色化学工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学
通过下列实验方法能达到实验目的是( )A.用焰色反应证明某物质是否为氯化钠B.用CaCl2鉴别碳酸
通过下列实验方法能达到实验目的是( )A.用焰色反应证明某物质是否为氯化钠B.用CaCl2鉴别碳酸钠和碳酸氢钠两种溶液C.通过颜色鉴别氧化钠和过氧化












