在25℃时 用石墨电极电解 溶液。5min后 在一个石墨电极上有6.4g Cu生成。试回答:(1)转
在25℃时,用石墨电极电解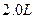 , ,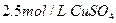 溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答: 溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:(1)转移电子的物质的量,得到 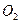 的体积(标准状况),溶液的 的体积(标准状况),溶液的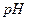 ? ?2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的 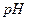 是否变化? (相对原子质量 Cu:64) 是否变化? (相对原子质量 Cu:64) |
参考解答
| (1)设转移电子的物质的量为x ,生成氧气的体积为V 2Cu2+ + 4e— = 2Cu 2 4 2 X 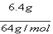 4:x='2:0.1mol ' x='0.2mol' 4:x='2:0.1mol ' x='0.2mol' 根据电子守恒:4OH— — 4e—= 2H2O + O2↑ 4 4mol 22.4L n(OH—) 0.2mol V 4mol :0.2mol =22.4L: V=1.12L。n(H+)=n(OH—)='0.2mol' c(H+)=0.2mol/2.0L=0.1mol/L 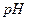 =-lgc(H+)=1. =-lgc(H+)=1.(2)用等质量的两块铜片代替石墨作电极,电极反应为: 阳极:Cu— 2e—=Cu2+ 阴极: Cu2+ + 2e— =' ' Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,电解后两铜片的质量相差为: 6.4g+6.4g=12.8g,溶液中c(H+)不变, 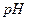 不变。 不变。 |
| 略 |
相似问题
(7分)如图所示(1)负极材料是 (2)正极的电极反应式为 (3)电池工作时
(7分)如图所示(1)负极材料是,(2)正极的电极反应式为,(3)电池工作时总反应的离子方程式是(4)电子的流向(5)阳离子的移动方向___________________________
镁——H2O2酸性电池采用海水作电解质(加入一定量酸) 下列说法正确的是( )A.电池总反应为M
镁——H2O2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是()A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2OB.负极反应为H2O2+2e-+ 2H+= 2H2
在理论上不能用于设计原电池反应的是( )A.Al(OH)3(s)+NaOH(aq)===NaAlO
在理论上不能用于设计原电池反应的是( )A.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+H2O(l);ΔH<0B.CH3CH2OH(l)+3O2―→2CO2(g)+3H2O(l);ΔH<0C.4Fe
(5分)利用下述反应 2FeCl3+Cu=2FeCl2+CuCl2设计一个原电池装置;试回答:(1)
(5分)利用下述反应 2FeCl3+Cu=2FeCl2+CuCl2设计一个原电池装置;试回答:(1)(3分)该原电池的正极材料是 ,负极材料是
(11分)按要求对下图中两极进行必要的连接并填空:(1)在A图中 使铜片上冒H2气泡。请加以必要连接
(11分)按要求对下图中两极进行必要的连接并填空:(1)在A图中,使铜片上冒H2气泡。请加以必要连接,则连接后的装置叫。电极反应式:锌极:;铜极:。












