A与B反应生成C 假定反应由A B开始 它们的起始浓度均为1 mol.L-1。反应进行2min后 A
| A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol.L-1。反应进行2min后,A的浓度为0.8 mol.L-1 ,B的浓度为0.6 mol.L-1 C的浓度为0.6 mol.L-1 (1)2min内反应的平均反应速率为: ν(A)= (2)ν(A)、ν(B)、ν(C) 三者之间的关系是: (3)该反应的化学反应方程式: |
参考解答
| (1)ν(A)=0.1 mol﹒L-1min-1(2)ν(A):ν(B):ν(C)=1:2:3(3)A+2B=3C |
试题分析:根据题意,反应进行到2min时A和B的浓度分别减少了0.2mol/L和0.4mol/L,同时生成了0.6mol/L,则根据变化量之比是相应的化学计量数之比可知,该反应的方程式是A+2B=3C。其中2min内反应的平均反应速率为ν(A)= 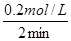 =0.1 mol﹒L-1min-1。因为反应速率之比是相应的化学计量数之比,所以ν(A)、ν(B)、ν(C) 三者之间的关系是ν(A):ν(B):ν(C)=1:2:3。 =0.1 mol﹒L-1min-1。因为反应速率之比是相应的化学计量数之比,所以ν(A)、ν(B)、ν(C) 三者之间的关系是ν(A):ν(B):ν(C)=1:2:3。点评:该题是基础性试题的考查,主要是考查学生对反应速率含义、计算以及反应速率和化学计量数关系的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力和学习效率。 |
相似问题
对反应A+3B2C+D来说 下列反应速率最快的是 ( )A.v(A)=0.2 mol/
对反应A+3B2C+D来说,下列反应速率最快的是()A.v(A)=0.2 mol/(L·min) B.v(B)=0.6 mol/(L·min)C v(C)= "0 5 " mol/(L·min) D v(D)= "0 01 " mol/(L·s)
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质 反应为:2NO(g)+2CO(g)N2(g)
汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)N2(g)+2CO2(g)DH=-a kJ mol(a>0)在某温度时,用气体传感器测得
某温度时 在2L密闭容器中某一反应中A B物质的量随时间变化的曲线如图所示:由图中数据分析并填写空格
某温度时,在2L密闭容器中某一反应中A、B物质的量随时间变化的曲线如图所示:由图中数据分析并填写空格:(1)该反应的化学方程式为____________________
下列各项不能用于比较化学反应速率快慢的是( ) A.气体的体积变化B.颜色的深浅变化C.焓变的大
下列各项不能用于比较化学反应速率快慢的是() A.气体的体积变化B.颜色的深浅变化C.焓变的大小D.反应的剧烈程度
1913年德国化学家哈伯发明了以低成本制造大量氨的方法 下列是哈伯法的流程图 其中为提高原料转化率而
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是A.①②③B.②④⑤C.①③⑤D.②③④












