氢气是一种新型的绿色能源 又是一种重要的化工原料。(1)氢气燃烧热值高。实验测得 在常温常压下 1g
| 氢气是一种新型的绿色能源,又是一种重要的化工原料。 (1)氢气燃烧热值高。实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2 燃烧的热化学方程式为__________________________________。 (2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验: ①氢氧燃料电池中,正极的电极反应式为____________ |
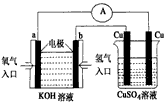 |
| ②上图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为____________L (3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 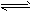 2NH3(g); 2NH3(g);ΔH=-92.4 kJ/mol ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。 |
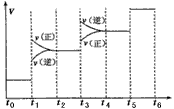 |
| 图中t1时引起平衡移动的条件可能是____________其中表示平衡混合物中NH3的含量最高的一段时间是 ____________ ②温度为T℃时,将2a mol H2和amol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。 |
参考解答
| (1)2H2(g)+O2(g)==2H2O(l);ΔH=-571.6 kJ/mol (2)①O2+4e-+2H2O=4OH-;②0.56 (3)①增大压强;t2-t3;② 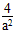 |
相似问题
用导线连接铁片和铜片 放入稀H2SO4中 可构成原电池 下列说法正确的是 [ ]A.Cu为负
用导线连接铁片和铜片,放入稀H2SO4中,可构成原电池,下列说法正确的是 [ ]A.Cu为负极,Fe为正极B.Fe为负极,Cu为正极 C.Fe被还原,Cu被氧化D.Fe被氧化,Cu被还原
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:CH4(g)+1/2O2(g)CO(g
(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:CH4(g)+1 2O2(g)CO(g)+2H2(g);△H=-36kJ mol……… ① CH4(g)+H2O(g)CO(g)+3H2(g);△H
银器皿日久表面逐渐变黑色 这是由于生成了硫化银(Ag2S)。有人设计用原电池的原理进行“抛光” 其处
银器皿日久表面逐渐变黑色,这是由于生成了硫化银(Ag2S)。有人设计用原电池的原理进行“抛光”,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 设计如图所示原电池 下列说法错误的
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是 [ ]A.X可以是银或石墨B.电子从铜电极经外电路流向X电极C.Y是硫
以多孔铂为电极 在下图装置中分别在两极区通入CH3OH和O2 发生反应产生电流 经测定 电流方向由b
以多孔铂为电极,在下图装置中分别在两极区通入CH3OH和O2,发生反应产生电流,经测定,电流方向由b到a,下列叙述中正确的是 [ ]A.A处通入O2 B.溶液












