已知25℃时 弱电解质的电离平衡常数:Ka(CH3COOH) Ka(HSCN)。在物质的量浓度均为m
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)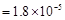 ,Ka(HSCN) ,Ka(HSCN) 。在物质的量浓度均为 。在物质的量浓度均为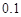 mol·L mol·L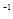 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( ) 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
|
参考解答
| A |
| 电离平衡常数越大,酸性越强。说明醋酸的酸性弱于HSCN的。但酸越弱,相应的钠盐越容易水解,碱性就越强。所以选项A正确,答案选A。 |
相似问题
下列事实与氨水是弱碱的事实无关的是( )A.氨水中NH4+ OH- NH3·H2O等微粒同时存在
下列事实与氨水是弱碱的事实无关的是()A.氨水中NH4+、OH-、NH3·H2O等微粒同时存在B.1mol L氨水溶液的pH=10C.1mol LNH4Cl溶液的pH=5D.氨水与AlCl3溶液反应生成Al(OH)3
(10分).根据电离理论:在水溶液中电离出的___________全部是__________的化合物
(10分).根据电离理论:在水溶液中电离出的___________全部是__________的化合物,叫做酸。因此酸具有通性,请用离子方程式表示下列酸的通性:(1)盐
下列电离子方程式正确的是 A.NaHCO3=Na++H++CO32-B.NaHS
下列电离子方程式正确的是A.NaHCO3=Na++H++CO32-B.NaHSO4=Na++H++SO42-C.H2SO4=2H++SO42-D.KClO3=K++Cl-+3O2-
将等体积 等pH的NaOH溶液和氨水 分别全部加入到甲 乙烧杯中。下列说法正确的是A.甲中沉淀一定比
将等体积、等pH的NaOH溶液和氨水,分别全部加入到甲、乙烧杯中。下列说法正确的是A.甲中沉淀一定比乙多B.乙中沉淀一定比甲多C.甲中沉淀可能比乙多D.
(16分)(1)已知298K时 Fe(OH)3的溶度积常数=2.6×10-39 Mg(OH)2的溶度
(16分)(1)已知298K时,Fe(OH)3的溶度积常数=2 6×10-39,Mg(OH)2的溶度积常数=5 6×,取适量浓度均为0 1mol L的MgCl2和FeCl3混合液(含HCl),加入一


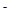 )>c(CH3COOH)>c(HSCN)>c(H
)>c(CH3COOH)>c(HSCN)>c(H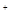 )
)









