甲酸甲酯水解反应方程式为:某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的
甲酸甲酯水解反应方程式为: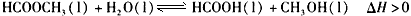 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表 |
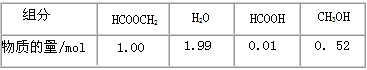 |
| 甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图 |
 |
| (1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表 |
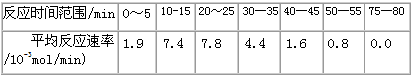 |
| 请计算15-20min范围内甲酸甲酯的减少量为________mol,甲酸甲酯的平均反应速率为________mol/min(不要求写出计算过程)。 (2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:___________________________________ (3)上述反应的平衡常数表达式为: 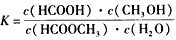 则该反应在温度T1下的K值为________________ 则该反应在温度T1下的K值为________________ (4)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。______________________ |
参考解答
| (1)0.045;9.0×l0-3 (2)该反应中用酸具有催化作用。 ①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。 (3)0.14 |
(4)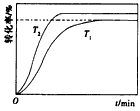 |
相似问题
如图所示 某刚性容器内有一活塞和弹簧 B为真空 A内已充入2molSO2和1molO2 在一定条件下
如图所示,某刚性容器内有一活塞和弹簧,B为真空,A内已充入2molSO2和1molO2,在一定条件下发生可逆反应2SO2+O2?2SO3;△H=-QkJ mol,(Q>0)一段时间后
某温度下 在一容积可变的容器中 反应2A(g)+B(g)2C(g)达到平衡时 A B和C的物质的量分
某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者
一个真空密闭恒容容器中盛有1molPCl5 加热到200℃发生如下反应: PCl5(g)PCl3 (
一个真空密闭恒容容器中盛有1molPCl5,加热到200℃发生如下反应: PCl5(g)PCl3 (g)+Cl2 (g) ,反应达到平衡时,混合气体中PCl5所占体积分数为M%。若
反应A(g)+B(g)?2C(g)+D(g);△H=QkJ/mol.过程中的能量变化如图所示 回答下
反应A(g)+B(g)?2C(g)+D(g);△H=QkJ mol.过程中的能量变化如图所示,回答下列问题.(1)Q______0(填“>”、“<”或“=”)(2)该反应平衡
化学平衡常数K表示可逆反应的进行程度 K值越大 表示____ K值大小与温度的关系是温度升高 K值_
化学平衡常数K表示可逆反应的进行程度,K值越大,表示____,K值大小与温度的关系是温度升高,K值____(填“一定增大”“一定减小”或“可能增大也可能减小”)。












