工业上用铬铁矿(主要成分FeO?Cr2O3 杂质为SiO2 Al2O3等)生产重铬酸钾(化学式K2C
工业上用铬铁矿(主要成分FeO?Cr2O3,杂质为SiO2、Al2O3等)生产重铬酸钾(化学式K2Cr2O,)的流程如下: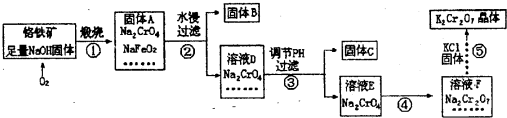 (1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有______等; (2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程式为______; (3)固体C中含有2种物质,要先加入下列物质中的______,然后才能进行过滤分离. A.氢氧化钠溶液 B.稀氨水 C.稀盐酸 (4)步骤④加入盐酸得到的溶液F中,除Na2Cr2O7外,还含有的溶质是______; (5)在上述流程中,有氧化还原反应发生的是第______步. (6)已知20℃时K2Cr2O7饱和溶液浓度为0.4mol?L-1,步骤⑤中加入固体氯化钾,若使K+离子浓度达到4mol?L-1(保持温度20℃),则溶液F中Cr2O2-7离子的浓度最大为______. |
参考解答
| (1)由题目信息可知,铬铁矿的主要成分FeO?Cr2O3,含有SiO2、Al2O3等杂质,SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2, 故答案为:Na2SiO3、NaAlO2; (2)NaFeO2水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO2+2H2O═NaOH+Fe(OH)3,故答案为:NaFeO2+2H2O═NaOH+Fe(OH)3; (3)由工艺流程可知,固体C中含有氢氧化铝与硅酸,氢氧化铝溶液强酸强碱,硅酸溶于强碱、不能与酸(HF除外)反应,故应加入盐酸,将氢氧化铝转化为偏铝酸钠,再过滤分离, 故选:C; (4)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,根据元素守恒还有氯化钠生成,故答案为:NaCl; (5)由工艺流程可知,第①步反应中,铁元素、铬元素、氧元素化合价反应变化,属于氧化还原反应,其它各步反应中元素的化合价未变化,不属于氧化还原反应, 故答案为:①; (6)20℃时K2Cr2O7饱和溶液浓度为0.4mol?L-1,该温度下c2(K+)?c(Cr2O2-7)=0.82?0.4=0.256,所以使K+离子浓度达到4mol?L-1(保持温度20℃),溶液F中Cr2O2-7离子的浓度最大为
|
相似问题
一天 小明走进实验室 看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题 展开了探究.(
一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.(1)小明提出下列猜想:猜想一:如果试剂完全变
能将AlCl3 Mg SO4 (NH4)2SO4 NH4Cl四种溶液区分开来的试剂是( )A.Ba
能将AlCl3、MgSO4、(NH4)2SO4、NH4Cl四种溶液区分开来的试剂是( )A.BaCl2B.Ba(OH)2C.NaOHD.AgNO3
不用任何试剂就可鉴别的是( )A.氨水和AlCl3B.KAlO2和KHSO4C.FeCl3和KOH
不用任何试剂就可鉴别的是( )A.氨水和AlCl3B.KAlO2和KHSO4C.FeCl3和KOHD.Na2CO3和HNO3
不能鉴别AgNO3 BaCl2 K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( )A.盐酸、硫酸B.盐酸、氢氧化钠溶液C.氨水、硫酸D.氨
某化学实验小组同学用如图所示装置进行系列实验 以探究气体的性质(部分仪器已略去).请回答:(1)若气
某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去).请回答:(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,












