碘酸钾是一种白色结晶粉末 无臭无味 酸性条件下碘酸钾是一种较强的氧化剂 与氢碘酸 二氧化硫等还原性物
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2↑(未配平)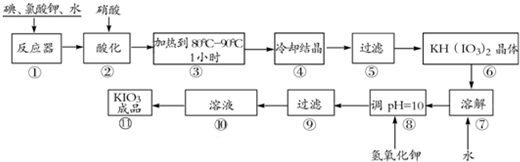 (1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______; (2)步骤②中,用稀酸酸化的作用是______;不能选用稀盐酸的原因是______; (3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为______; (4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是______.
|
参考解答
| (1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑. 故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑. (2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出. 酸性条件下碘酸钾是一种较强的氧化剂,盐酸能还原已生成的碘酸氢钾. 故答案为:促进氯气从反应混合物中逸出;盐酸能还原已生成的碘酸氢钾. (3)由信息可知,碘酸钾能被氯气氧化为高碘酸钾,所以要将完全排出氯气,防止碘酸钾被氧化. 故答案为:Cl2能将KIO3氧化成KIO4. (4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶. 故答案为:蒸发结晶. |
相似问题
下列物品的鉴别方法不正确的是( )A.用焰色反应鉴别NaCl KCl和Na2SO4B.用氢氧化钠溶
下列物品的鉴别方法不正确的是( )A.用焰色反应鉴别NaCl、KCl和Na2SO4B.用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液C.利用丁达尔效应鉴别Fe(OH)3胶
只用一种试剂(可加热)就能鉴别出NH4Cl Na2SO4 (NH4)2CO3 三种溶液 应选用(
只用一种试剂(可加热)就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3、三种溶液,应选用( )A.BaCl2B.HClC.NaOHD.Ba(OH)2
只用一种试剂就能将甲苯(已经其密度比水小) 己烯 四氯化碳 碘化钾溶液区分开来 这种试剂是( )A
只用一种试剂就能将甲苯(已经其密度比水小)、己烯、四氯化碳、碘化钾溶液区分开来,这种试剂是( )A.溴水B.溴化钾溶液C.硝酸银溶液D.酸性KMnO4溶液
有一瓶硫酸钠溶液可能混有少量氯化钠 请设计实验方案检验溶液中氯化钠是否存在:______.
有一瓶硫酸钠溶液可能混有少量氯化钠,请设计实验方案检验溶液中氯化钠是否存在:______.
如图所示装置进行实验(图中铁架台等仪器均已略去).在I中加入试剂后 塞紧橡皮塞 立即打开止水夹 II
如图所示装置进行实验(图中铁架台等仪器均已略去).在I中加入试剂后,塞紧橡皮塞,立即打开止水夹,II中有气泡冒出;一段时间后关闭止水夹,II中液面上












