(1)1molO2与足量氢气反应产生水蒸气放热483.6kJ 若1g水蒸气转化成液态水放热2.444
| (1)1molO2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式:______. (2)由汽油裂解得到乙烯、丙烯是重要的化工原料,请写出下列转化的方程式,并注明反应类型. 丙烯→聚丙烯______ (3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N22mol、H21.5mol、NH32mol.则用氮气浓度的减少来表示该反应速率为______. (4)在500ml密闭容器中,将2molA和1molB混合加热到500℃,达到平衡2A(g)+B(g)?3C(g)K=16求A转化为C的转化率为______. (5)在密闭容器中发生下列反应:aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则a______c+d(填“>”、“=”或“<”). (6)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为______. 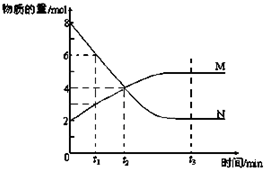 |
参考解答
(1)1mol O2与足量氢气反应产生水蒸气放热483.6kJ,反应的热化学方程式为:①H2(g)+
若1g水蒸气转化成液态水放热2.444kJ,1mol水蒸气变化为液态水放热43.992KJ,②H2O(g)=H2O(l)△H=-43.992KJ/mol, 由盖斯定律①+②得到:H2(g)+
则表示氢气燃烧热的热化学方程式为H2(g)+
故答案为:H2(g)+
(2)丙烯加成聚合生成聚丙烯,反应的化学方程式为:  ,为加成聚合反应; ,为加成聚合反应;故答案为:  ,加成聚合反应; ,加成聚合反应;(3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N2 2mol、H21.5mol、NH32mol. N2+3H2=2NH3 起始量(mol)3 4.5 0 变化量(mol) 1 3 2 4s末(mol) 21.5 2 则用氮气浓度的减少来表示该反应的反应速率=
故答案为:0.125mol/L?s; (4)在500ml密闭容器中,将2mol A和1molB混合加热到500℃,AB的浓度c(A)=4mol/L,c(B)=2mol/L,达到平衡 K=16,设A转化物质的量浓度为x 2A(g)+B (g)?3C(g) 起始量(mol/L) 4 2 0 变化量(mol/L) x 0.5x 1.5x 平衡量(mol/L) 4-x 2-0.5x 1.5x K=
计算得到x=2.284mol/L; A转化为C的转化率=
故答案为:57.1%; (5)反应达到平衡后,将气体体积压缩到原来的一半,不考虑平衡移动,物质的浓度变为原来的2倍,题干中A的浓度为原平衡 的2.1倍,说明增大压强平衡逆向进行,aA(g)?cC(g)+dD(g),a<c+d,故答案为:<; (6)达到平衡时,N的物质的量为2mol,变化6mol,M的物质的量为5mol,变化3mol,反应的方程式为2N?M,故答案为:2N?M. |
相似问题
下列热化学方程式能正确表示可燃物的标准燃烧热的是 [ ]A.H2(g)+ 1/2O2(g
下列热化学方程式能正确表示可燃物的标准燃烧热的是 [ ]A.H2(g)+1 2O2(g)==H2O(g);△H=-242 0kJ mol B.CH4(g)+2O2(g)==CO2(g)+2H2O(
今有如下三个热化学方程式:下列关于它们的表述正确的是( )H2(g)+1/2O2(g)H2O(g)
今有如下三个热化学方程式:下列关于它们的表述正确的是( )H2(g)+1 2O2(g)H2O(g);△H=akJ molH2(g)+1 2O2(g)H2O(l);△H=bkJ mol2H2(
下列依据热化学方程式得出的结论正确的是( )A.已知C(石墨 s)═C(金刚石 s)△H>0 则金
下列依据热化学方程式得出的结论正确的是( )A.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定B.已知C(s)+O2(g)═CO2(g)△H1C
4克硫粉完全燃烧时放出37千焦热量 该反应的热化学方程式是:
4克硫粉完全燃烧时放出37千焦热量,该反应的热化学方程式是:
20世纪30年代 Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过












