如图所示 某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理 其中乙装置
如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.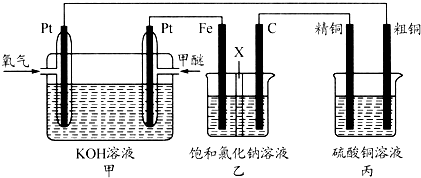 根据要求回答相关问题: (1)通入氧气的电极为______(填“正极”或“负极”),写出负极的电极反应式______. (2)铁电极为______(填“阳极”或“阴极”),石墨电极(C)的电极反应式为______. (3)反应一段时间后,乙装置中生成氢氧化钠主要在______(填“铁极”或“石墨极”)区,简述理由是______. (4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______,反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”). (5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为______;丙装置中阴极析出铜的质量为______. |
参考解答
| (1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O, 故答案为:正极;CH3OCH3-12e-+16OH-═2CO32-+11H2O; (2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑, 故答案为:阴极;2Cl--2e-═Cl2↑; (3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区, 故答案为:铁极;石墨为阳极,氯离子发生氧化反应,铁为阴极,H+反应,生成OH-,由于阳离子交换膜只允许钠离子向阴极区移动,故氢氧化钠主要在阴极区生成; (4)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜离子,阳极电极方程式分别为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小, 故答案为:Zn-2e-=Zn2+、Cu-2e-=Cu2+;减小; (5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y. O2-------2H2-------2Cu 22.4L 2×6.02×1023 128g 2.24L x y x=0.2×6.02×1023; y=12.8g, 故答案为:0.2×6.02×1023;12.8 g. |
相似问题
对图所示装置的叙述 错误的是( )A.锌是负极 其质量逐渐减小B.电流由锌片经导线流向铜片C.H+
对图所示装置的叙述,错误的是( )A.锌是负极,其质量逐渐减小B.电流由锌片经导线流向铜片C.H+在铜片表面被还原,产生气泡硫酸D.锌片上发生氧化
下列与装置有关的说法正确的是( )A.图a中 随着电解的进行溶液中H+的浓度越来越大B.图b中 M
下列与装置有关的说法正确的是( )A.图a中,随着电解的进行溶液中H+的浓度越来越大B.图b中,Mg电极作电池的负极C.图c中,发生的反应为Co+Cd2+=Cd+
下列各组材料中 能组成原电池的是:( )ABCD两极材料Zn片 Cu片Cu片 Cu片Zn片 Cu片
下列各组材料中,能组成原电池的是:( )ABCD两极材料Zn片、Cu片Cu片、Cu片Zn片、Cu片Zn片、Cu片插入溶液稀H2SO4NaCl溶液植物油酒精A.AB.BC.CD.D
(3分) 对于反应2A(g)+B(g)2C(g)+Q (Q>0) 下列图象正确的是
(3分) 对于反应2A(g)+B(g)2C(g)+Q (Q>0),下列图象正确的是
下列关于右图所示的装置的叙述 正确的是( )A.铜片质量逐渐减少B.锌片上有气泡产生C.氢离子在铜
下列关于右图所示的装置的叙述,正确的是( )A.铜片质量逐渐减少B.锌片上有气泡产生C.氢离子在铜片表面被还原D.电流从锌片经导线流向铜片












