铅蓄电池的两极分别为Pb PbO2 电解液为硫酸 工作时的反应为Pb+PbO2+2H2SO4=2Pb
铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是( )。
|
参考解答
| D |
分析化学反应可知,反应中Pb失去电子,作负极;PbO2得电子,作正极,反应不断消耗硫酸,溶液的pH不断增大;无论Pb还是PbO2最终都生成PbSO4,所以S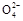 既向Pb也向PbO2处移动;PbSO4在电解液中的溶解度很小,所以电解液的密度不断减小,选D。 既向Pb也向PbO2处移动;PbSO4在电解液中的溶解度很小,所以电解液的密度不断减小,选D。 |
相似问题
一种燃料电池中发生的化学反应式:在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是
一种燃料电池中发生的化学反应式:在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是 [ ]A.CH3OH(g)+O2(g)=H2O(l)+CO2(g)+2H+
近来报道 含镍烤瓷牙可能导致人体出现不良反应。粗镍中含有少量杂质Fe Zn Cu Pt 可用电解法制
近来报道,含镍烤瓷牙可能导致人体出现不良反应。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知氧化性:Fe2+<Ni2+<Cu2+),下列叙
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是 [
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是 [ ]A CH3OH+O2=H2O+CO2+2H++2e- B O2+4H++4e
结合下图判断 下列叙述正确的是[ ]A.I和Ⅱ中正极均被保护 B.I和Ⅱ中负极反应均是F
结合下图判断,下列叙述正确的是[ ]A I和Ⅱ中正极均被保护 B I和Ⅱ中负极反应均是Fe-2e-=Fe2+ C I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-D I和Ⅱ中分别加
难溶电解质AB2饱和溶液中 c(A+)=x mol·L-1 c(B-)=y mol·L-1 则Ksp
难溶电解质AB2饱和溶液中,c(A+)=x mol·L-1,c(B-)=y mol·L-1,则Ksp值为[ ]A.1 2xy2 B.xy C.xy2 D.4xy2












