常温下 将某一元酸HA和NaOH溶液等体积混合 两种溶液的浓度和混合后所得溶液的pH如下表:实验编号
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答下列问题: (1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HB是强酸还是弱酸________。 (2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L________?(填“是”或“否”)。混合溶液中离子浓度c(B-)与c(K+)的大小关系是________。 A.前者大 B.后者大 C.二者相等 D.无法判断 (3)从丙组实验结果分析,HB是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。 (4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算),c(K+)-c(B-)=_mol/L。 |
参考解答
| (1)若a=7,则HB为强酸,若a>7,则为弱酸 (2)否;C (3)弱;c(Na+)>c(B-)>c(OH-)>c(H+) (4)10-5;10-5-10-9 |
(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是KB,对KB溶液分析,若a=7,说明HB是强酸,若a>7,说明溶液因B-的水解而显碱性,则HB是弱酸。(2)c1不一定等于0.2。当HB是强酸时等于0.2;当HB是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(K+)=c(B-)。(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7。说明B-水解,得到HB是弱酸,其他易推知。(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9mol/L,则由水电离产生的c(H+)=c(OH-)=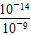 =10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。 =10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。 |
相似问题
(12分)某研究性学习小组为证明在同温同压下 相同浓度相同体积的不同强度的一元酸与足量镁带反应时 生
(12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验
25℃时 水的离子积为Kw 该温度下将 a mol·L-1一元酸 HA 与b mol·L-1一元强碱
25℃时,水的离子积为Kw,该温度下将 a mol·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全中和,下列结论中不正确的是A.混合
有0.1 mol·L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa 下列说法正确的
有0 1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是A.溶液①中,c(CH3COO-)= c(H+)B.溶液①、②等体积混合,混合液中c(CH
在0.1 mol/L氨水中 分别加入少量下列物质 溶液中的c(OH-)增大的是A.加少量HNO3B.
在0 1 mol L氨水中,分别加入少量下列物质,溶液中的c(OH-)增大的是A.加少量HNO3B.加少量KOH固体C.加少量(NH4)2SO4固体D.加大量水
下列能正确表示水解的离子方程式是A.CH3COOH + H2O CH3COO- + H3O+B.NH
下列能正确表示水解的离子方程式是A.CH3COOH + H2O CH3COO- + H3O+B.NH4+ + H2O NH3·H2O + H+C.CO32- + 2H2O H2CO3 + 2OH-D.Br- + H2O HBr + OH-












