在25ml 0. 1molNaOH溶液中逐滴加入。0.2molCH3COOH溶液 溶液pH变化曲线如
在25ml 0. 1mol NaOH溶液中逐滴加入。0.2mol NaOH溶液中逐滴加入。0.2mol CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是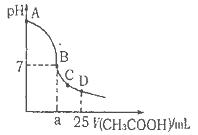 A.在A、B间任一点(不含A、B点),溶液中可能有 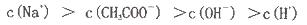 B.在C点, 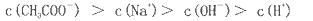 C.在B点, 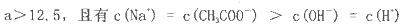 D.在D点, 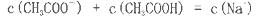 |
参考解答
| C |
试题分析:A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),故A正确; B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误; C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误; D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)='2c' (Na+)故D错误;故选A。 |
相似问题
写出下列物质的电离方程式:(1)Al2(SO4)______(2)NaHCO3______.
写出下列物质的电离方程式:(1)Al2(SO4)______(2)NaHCO3______.
在下列各物质的水溶液中不能电离出氯离子的化合物是[ ]A.MgCl2 B.KClO3 C
在下列各物质的水溶液中不能电离出氯离子的化合物是[ ]A.MgCl2 B.KClO3 C.BaCl2 D.HCl
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。 I.某兴趣小组在实验室中制备碳酸钠溶液
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。 I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液
25℃时 将0.1mol·L-1氨水溶液加水稀释 下列数值变大的是A.c(OH-)B.pHC.c(N
25℃时,将0 1mol·L-1氨水溶液加水稀释,下列数值变大的是A.c(OH-)B.pHC.c(NH4+) c(NH3·H2O)D.c(H+)·c(OH-)
pH=2的两种一元酸x和y 体积均为100 mL 稀释过程中pH与溶液体积的关系如下图所示。分别滴加
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0 1 mol·L-1)至pH=7,消耗NaOH溶液的体积












