乙醇是重要的化工原料和液体燃料 可以在一定条件下利用CO2与H2反应制取:2CO2(g)+6H2(g
| 乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制取: 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0 请回答:(1)该反应的化学平衡常数表达式为______. (2)当温度T1>T2时,化学平衡常数K1______K2(填“>”、“<”或“=”). (3)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有______(写出一条合理措施即可). (4)工业上,常以乙醇为原料生产乙醛.根据如图所示信息,该反应是______反应(填“放热”或“吸热”),判断依据是______. 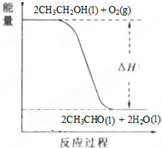 |
参考解答
(1)可逆反应2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)的平衡常数k=
故答案为:
(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,即温度越高,平衡常数越小,温度T1>T2,故K1<K2,故答案为:<; (3)改变条件加快反应速率,同时平衡向正反应移动,可以增大CO2浓度或增大压强,反应速率加快,平衡向正反应移动氢气的转化率增大,故答案为:增大CO2浓度或增大压强; (4)由图象可知,反应物的总能量大于生成物的总能量,故该反应物为放热反应, 故答案为:放热,反应物的总能量大于生成物的总能量. |
相似问题
将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中 在一定条件下反应:2SO2
将2molSO2和2molSO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)2SO3(g),平衡时SO3为Wmol。相同温度下,分别按下列配比在相同
在某温度下 容积均为1L的三个密闭容器中 按不同方式投入反应物 保持恒温恒容 使之发生反应:2SO2
在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)2SO3(g)△H=-196kJ mol.初始投料与
水煤气是重要燃料和化工原料 可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)═CO (g)+H
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)═CO(g)+H2(g)△H=+131 3kJ?mol-1(1)该反应的平衡常数K随温度的升高
将物质的量均为2.00mol的物质X Y混合 发生如下反应:2X+Y2W.在反应过程中W的物质的量
将物质的量均为2 00mol的物质X、Y混合,发生如下反应:2X+Y2W.在反应过程中W的物质的量分数随温度变化如图所示:(1)T0对应的V正和V逆的关系是V正_____
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体 熔点- 54.1℃ 沸点 69.1℃ 遇水
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点- 54 1℃,沸点 69 1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭的












