(12分)如下图 通电5 min后 电极5质量增加2.16 g 回答:(1)电源:a是_______
(12分)如下图,通电5 min后,电极5质量增加2.16 g,回答: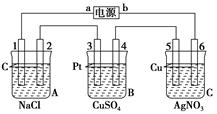 (1)电源:a是________极,b是________极;A池电极反应,电极1:__________; 电极2:____________________________________________________________。 C池电极反应,电极5:________________________________________________; 电极6:______________________________________________________________。 (2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。 |
参考解答
| (1)负 正 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2Ag++2e-===2Ag Cu-2e-===Cu2+ (2)0.025 mol/L |
试题分析:(1)通电5 min后,电极5质量增加2.16 g,这说明电极5是阴极,所以电极是阳极。则b是电源的正极,a是电源的负极。因此电极1是阴极,氢离子放电生成氢气,电极反应式是2H++2e-===H2↑。电极2是阳极,溶液中的氯离子放电生成氯气,电极反应式是2Cl--2e-===Cl2↑。C装置中电极5是阴极,溶液中的银离子放电,电极反应式是2Ag++2e-===2Ag。电极6是阳极,但电极是铜电极,所以铜失去电子,电极反应式是Cu-2e-===Cu2+。 (2)电极5生成银的质量是2.16g,物质的量是0.02mol,转移0.02mol电子。B池中共收集到224 mL气体(标准状况),则气体的物质的量是0.01mol。如果气体全部是氧气,则转移电子是0.04mol。显然电子的得失不守恒,所以生成的气体中还含有氢气。根据电子的得失守恒可知,阳极生成氧气的物质的量是0.02mol÷4=0.005mol,所以阴极生成的氢气是0.01mol-0.005mol=0.005mol。则阴极析出的铜的物质的量是(0.02mol-0.005mol×2)÷2=0.005mol,因此电解硫酸铜溶液的物质的量浓度是0.005mol÷0.2L='0.025' mol/L。 点评:该题的难点在(2)问,需要利用电子守恒,通过讨论得出阴极还有氢气生成,最后再通过电子的守恒计算即可,属于中等难度的试题。 |
相似问题
常温时 用某新型充电电池电解如右图所示的l00mL溶液 充电电池的总反应为4Li+2SOCl2 4
常温时,用某新型充电电池电解如右图所示的l00mL溶液,充电电池的总反应为4Li+2SOCl2 4LiCl +S+SO2,则下列叙述中不正确的是A.若仅闭合K2,铁极的电极
下图两个装置中 液体体积均为200mL 开始工作前电解质溶液的浓度均为0.5 mol·L-1 工作一
下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0 5 mol·L-1,工作一段时间后,测得有0 02 mol电子通过,若忽略溶液体积的变化,
(16分)电解原理在化学工业中有广泛应用。右图表示一个电解池 装有电解液a;X Y是两块电极板(X
(16分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B 是出口,通过导线与直流电源相
给你提供纯锌 纯铜片和500mL0.2mol·L-1的H2SO4溶液 导线 1000mL量筒。试用下
给你提供纯锌、纯铜片和500mL0 2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。(
某课外活动小组同学用下图装置进行实验 一段时间后在C电极表面有铜析出 试回答下列问题。(1)A为电源
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。(1)A为电源的极;(2)E的电极反应式为:;(3)若甲、乙装












