(8分)(I)已知:在298 K 1.01KPa下 由稳定的单质发生反应生成1 mol气态化合物的反
(8分)(I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题: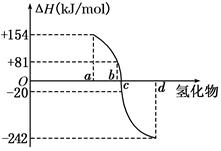 请你归纳出 (I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________; 写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。 (II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。 (III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应: 负极: 正极: |
参考解答
| ( 8分)(1)非金属元素氢化物越稳定,△H越小;△H=' –' 81KJ/mol(1分) (2)△H=(2A+B–4C)kJ/mol(1分) (3)C4H10+13 O2- -26e-=4CO2+5H2O (2分)O2+4e-=2O2- (2分) |
| (1)非金属元素越活泼,生成的氢化物越稳定,放出的热量越多,生成热△H越小;故氢化物a、b、c、d的分别为H2Te、H2Se、H2S、H2O,H2Se的生成热为+81KJ/mol,反之,硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H=– 81KJ/mol (II)硅的燃烧反应为:Si+O2  SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol(III)燃料电池的总反应为:2C4H10+13O2=8CO2+10H2O 氧气在正极得电子:O2+4e-=2O2- 丁烷在负极失电子并得到O2-:C4H10+13 O2--26e-=4CO2+5H2O(总反应减去正极反应即可) |
相似问题
下列有关反应限度的叙述正确的是A.大多数化学反应在一定条件下都有一定的限度B.依据焓判据:NH4HC
下列有关反应限度的叙述正确的是A.大多数化学反应在一定条件下都有一定的限度B.依据焓判据:NH4HCO3受热分解可自发进行C.使用催化剂,既能加快反应速
下列有关热化学方程式的表示及说法正确的是 ( )A.已知c(石墨 s)=c(金刚石
下列有关热化学方程式的表示及说法正确的是()A.已知c(石墨,s)=c(金刚石,s);△H>0,则金刚石比石墨稳定B.已知I2(g)+H2(g)=2HI(g),△H
关于下列三个反应的说法正确的是①101 kPa时 2C(s)+O2(g)===2CO(g)
关于下列三个反应的说法正确的是①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1②2H2O(g) ===2H2(g)+O2(g) ΔH=+571 6 kJ·mol-1③稀
下列反应符合下图图示的是 ( )A.铝片与盐酸的反应B.Ba(OH)2·8H2O与NH4Cl
下列反应符合下图图示的是 ( )A.铝片与盐酸的反应B.Ba(OH)2·8H2O与NH4Cl晶体的反应C.酸碱中和反应D.甲烷在氧气中的燃烧反应
下列过程中 共价键被破坏的是 ( )A.碘升华 B.HI气体受热分解C.食盐熔化D.蔗糖溶于
下列过程中,共价键被破坏的是()A.碘升华 B.HI气体受热分解C.食盐熔化D.蔗糖溶于水












