如图1所示是工业生产硝酸的流程:合成塔中内置铁触媒 氧化炉中内置Pt-Rh合金网.请回答下列问题:(
如图1所示是工业生产硝酸的流程: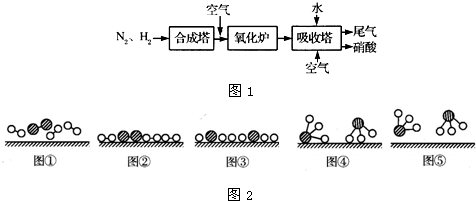 合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网.请回答下列问题: (1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图2所示. 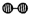 、 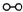 、  分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______. (2)合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g),写出该反应的化学平衡常数表达式K=______.在一定温度和压强下,将H2 和N2 按3:1(体积之比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3 的体积分数为15%,此时H2 的转化率为______. (3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol,氨催化氧化的热化学方程式为______. (4)吸收塔中通入空气的目的是______. |
参考解答
| (1)、分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,故答案为:图②表示N2、H2被吸附在催化剂表面,图③表示在催化剂表面,N2、H2中化学键断裂; (2)、化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.根据以上概念可以写出该反应的化学平衡常数表达式 K=
故答案为:K=
(3)、已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol ① N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol ② ①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol 故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol; (4)、不断通入空气,提供充足的氧气,以便使NO循环利用,全部转化成硝酸. 故答案为:使NO循环利用,全部转化成硝酸. |
相似问题
下列各项与反应热的大小无关的是[ ]A.反应物和生成物的状态 B.反应物量的多少 C.反应物
下列各项与反应热的大小无关的是[ ]A.反应物和生成物的状态 B.反应物量的多少 C.反应物的性质 D.反应的快慢
下列说法或表示方法正确的是( )A.反应物的总能量低于生成物的总能量时 该反应一定不能发生B.由石
下列说法或表示方法正确的是( )A.反应物的总能量低于生成物的总能量时,该反应一定不能发生B.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s
下列热化学方程式书写正确的是( )A.C(s)+O2(g)═CO2(g);△H=+393.5kJ/
下列热化学方程式书写正确的是( )A.C(s)+O2(g)═CO2(g);△H=+393 5kJ molB.2SO2+O2═2SO3;△H=-196 6kJ molC.H2(g)+12O2(g)═H2O(l
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0 4mol液态肼和0 8molH2O2混合反应,生成氮气和水蒸气,放出256 7kJ的热量(相当于25
在相同的温度和压强下 将32 g硫分别于纯氧中和空气中完全燃烧 令前者放出的热量为Q1 后者放出的热
在相同的温度和压强下,将32 g硫分别于纯氧中和空气中完全燃烧,令前者放出的热量为Q1,后者放出的热量为Q2,则关于Q1和Q2相对大小,正确的判断是 [ ]












