回答下列各题:(1)在探究原电池中电极与电解质溶液之间的关系时 某同学设计了用铝片 铜片作电极 用浓
| 回答下列各题: (1)在探究原电池中电极与电解质溶液之间的关系时,某同学设计了用铝片、铜片作电极,用浓硝酸作电解质溶液的原电池,则铜片为原电池的______极,铝片上的电极反应式为______. (2)通过______装置( 填“原电池”或“电解池”)可以实现如下反应: Cu+2H2O═Cu(OH)2+H2↑ 该装置应以铜为______极,并可选用下列溶液中的______为电解质溶液(填符号). A.H2SO4溶液 B.NaOH溶液 C.CuSO4溶液 D.NaCl溶液 (3)如图所示的两个电解槽中,A、B、C、D均为石墨电极.电解过程中,乙中反应的离子方程式为______. 若乙烧杯中D极上产生224mL标准状况下的气体,则甲烧杯中B极上可析出铜______g(铜的相对原子质量为64). 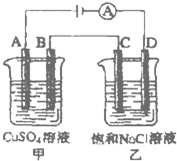 |
参考解答
| (1)铝片、铜片、浓硝酸构成的原电池中,常温下,铝片能与浓硝酸发生钝化现象,铜能与浓硝酸自发的发生氧化还原反应,铜片作负极,铝片作正极,正极上硝酸根离子得电子和氢离子生成二氧化氮和水,电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O, 故答案为:负极;4H++2NO3-+2e-=2NO2↑+2H2O; (2)Cu+2H2O═Cu(OH)2+H2↑该反应不能自发的进行氧化还原反应,所以不能构成原电池只能构成电解池,利用外接电源使其强制发生氧化还原反应. 该反应中铜失电子发生氧化反应,所以铜片作阳极,阴极上水分子放电生成氢气和氢氧根离子,发生还原反应. A.如果电解硫酸溶液,阴极上先氢离子放电生成氢气,随着反应的进行,阳极上生成的铜离子进入溶液,后阴极上铜离子放电不是氢离子放电,故A错误; B、电解氢氧化钠溶液时,阴极上氢离子放电,阳极上生成的铜离子和氢氧根离子生成氢氧化铜沉淀,所以阴极上始终没有铜离子得电子,故B正确; C、电解硫酸铜溶液时,阴极上铜离子放电生成铜单质,不是氢离子放电,故C错误; D.电解NaCl溶液时,阴极上氢离子放电同时生成氢氧根离子,阳极上生成的铜离子和氢氧根离子反应生成氢氧化铜沉淀,符合电池反应式,故D正确; 故答案为:电解池;阳极;BD; (3)电解时,乙中阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,所以电池反应式为:2Cl-+2H2O=Cl2↑+H2↑+2OH-, 乙烧杯中D极连接电源的负极,所以D极作阴极,D极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-, 甲烧杯中B作阴极,阴极上铜离子得电子生成铜单质,电极反应式为2Cu2++2e-=Cu, 根据电解池工作时,阴阳极上得失电子相等, 设生成铜的质量为X,氢气和铜的关系式为 Cu--H2↑ 64g 22.4L X 0.224L x=0.64g 故答案为:2Cl-+2H2O=Cl2↑+H2↑+2OH-;0.64g. |
相似问题
如图是化学能与电能相互转换的两套装置 对此两套装置的分析正确的是( )A.两装置中 铁电极上均有较
如图是化学能与电能相互转换的两套装置,对此两套装置的分析正确的是( )A.两装置中,铁电极上均有较大量气体产生B.图2装置中铁片上发生氧化反应C
有一合金由X Y Z W四种金属组成 若将合金放入盐酸中 只有Z Y能溶解;若将合金置于潮湿空气中
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中,只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.请回答:I.用图1所示装置进行第一组实验
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.请回答:I.用图1所示装置进行第一组实验.(1)在保证电极反应不变的情况下,不能替代Cu
用铜和硫酸铜 银和硝酸银溶液设计一个原电池 电池的总反应的离子方程式是______负极反应式是___
用铜和硫酸铜、银和硝酸银溶液设计一个原电池,电池的总反应的离子方程式是______负极反应式是______;正极反应式是:______.
下列说法正确的是( )A.钢铁发生电化腐蚀的正极反应式:Fe→Fe2++2e-B.氢氧燃料电池的负
下列说法正确的是( )A.钢铁发生电化腐蚀的正极反应式:Fe→Fe2++2e-B.氢氧燃料电池的负极反应式:O2+2H2O+4e-→4OH-C.粗铜精炼时,与电源正极相












