把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中 使它们发生如下反应:3X(g)+
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)===nZ(g)+2W(g),在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示平均反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的化学计量数n的值是( )
|
参考解答
| D |
试题分析: 3X(g) + Y(g) === nZ(g) + 2W(g) 起始 0.6mol 0.4mol 0 0 变化 0.3mol 0.1mol 0.1nmol 0.2mol 5min剩余 0.3mol 0.3mol 0.1nmol 0.2mol 根据速率公式可知v(Z)= 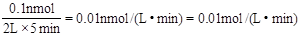 ,则n=1。答案选D。 ,则n=1。答案选D。点评:三段式在化学平衡计算中非常基础和重要。 |
相似问题
17..对于反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) 下列叙述不正确的
17. 对于反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ,下列叙述不正确的A.其反应物或生成物都能用来表示该反应的速率B.反应过程中能量关系可用上图表示
在2A+B 3C+4D反应中 表示该反应速率最快的是( )A.v(A)=0.5 mol&midd
在2A+B 3C+4D反应中,表示该反应速率最快的是( )A.v(A)=0 5 mol·L-1·s-1B.v(B)=0 3 mol·L-1·s-1C.v(C)=0 8 mol·L
已知:4NH3+5O2 4NO+6H2O 若反应速率分别用 [(mol / (L·min)]表示
已知:4NH3+5O24NO+6H2O,若反应速率分别用、、、[(mol (L·min)]表示,则正确的关系是 ( ) A.4=5B.5=6C.2=3D.4=5
某温度时 2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析 该反应的化学方程式
某温度时,2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均速率分别为A.3X+Y
在某一化学反应 0.5L的密闭容器中 反应物B的物质的量在5s内从2.0mol变成0.5mol 在这
在某一化学反应,0 5L的密闭容器中,反应物B的物质的量在5s内从2 0mol变成0 5mol,在这5s内B的化学反应速率为()A.3mol (L?s) B.0 3mol (L?s)C.0 6mol (L?s)D.0 1mol (L?s)












